報道関係各位
MSD株式会社
この参考資料は、Merck & Co., Inc., Rahway, N.J., USAが2023年4月27日付(米国東部時間)で発表した2023年度第1四半期決算のプレスリリースMerck Announces First-Quarter 2023 Financial Resultsを日本語に翻訳したもので、内容および解釈については英語が優先されます。
以下の医療用医薬品は、日本国内で発売しております。カナ表記は括弧内をご参考ください。
BRIDION®(ブリディオン®)、GARDASIL®(ガーダシル®)、GARDASIL®9(日本ではシルガード®9)、JANUVIA®(ジャヌビア®)、KEYTRUDA®(キイトルーダ®)、Lenvima®(レンビマ®)、Lynparza®(リムパーザ®)、ROTATEQ®(ロタテック®)、ZERBAXA®(ザバクサ®)、LAGEVRIO®(ラゲブリオ®)、VAXNEUVANCE™(バクニュバンス®)、PNEUMOVAX ®23(ニューモバックス®NP)
参考資料
Merck & Co., Inc., Rahway, N.J., USA
2023年度第1四半期決算発表
- 2023年度第1四半期は、オンコロジーやワクチン領域をはじめとする主要な成長ドライバーにおいて持続的で堅調な業績基盤を反映
- 2023年度第1四半期の全世界売上高は、前年同期比9%減の145億ドル。LAGEVRIOの売上を除き11%増の成長。LAGEVRIOの売上および為替の影響を除き15%増の成長。
- KEYTRUDAの売上高は、20%の成長で58億ドル(為替の影響を除き24%増)
- GARDASILおよびGARDASIL 9の売上高は、35%の成長で20億ドル(為替の影響を除き43%増)
- LAGEVRIOの売上高は、88%の減少で3億9,200万ドル(為替の影響を除き87%減)
- 2023年度第1四半期のGAAPベースのEPSは1.11ドル、non-GAAPベースでは1.40ドル。GAAP およびnon-GAAPベースのEPSは、Imago社の買収、Kelun-Biotech社との提携およびライセンス契約に関連する負担費用0.52ドルを含む
- 免疫系パイプラインを強化するため、Prometheus Biosciences の買収提案を発表
- 革新的な心血管系パイプラインによる以下の有望なデータを発表:
- sotaterceptによる第3相試験の良好な結果
- MK-0616による第2b相試験の良好な結果(2023年に第3相試験を開始予定)
- 先進的なオンコロジー研究への取り組みとして特定の腫瘍タイプにおける早期がんに関する以下の進展を発表:
- 第3相KEYNOTE-671試験の良好な結果を発表
- Moderna社との提携のもと、第2b相KEYNOTE-942/mRNA-4157-P201試験の良好な結果の詳細を発表
- 2023年度業績見通し
- 2023年度通期の全世界売上高を577億ドル~589億ドルに上方修正(為替のマイナス影響約2%ポイントを含む。業績見通しには、LAGEVRIOの売上約10億ドルを含む)
- 2023年度通期のGAAPベースのEPSレンジを5.85ドル~5.97ドルに下方修正(Zetiaの反トラスト訴訟の和解に関連する費用を反映)
- 2023年度通期のnon-GAAPベースのEPSレンジを6.88ドル~7.00ドルに上方修正(為替のマイナス影響約4%ポイントを含む)
- 業績見通しには、Prometheus Biosciences の買収提案による影響を反映していません。2023年度第3四半期には完了見込みで、最終的に、GAAPおよびnon-GAAPベースの業績に約103億ドルまたは一株当たりの約4.00ドルを一括で計上予定
米国ニュージャージー州ローウェイ– Merck & Co., Inc., Rahway, N.J., USA(米国とカナダ以外ではMSD)は2023年4月27日、2023年度第1四半期決算を発表しました。
会長兼最高経営責任者(CEO)ロバート・M・デイビスは、「重要なアンメットニーズに応えるため、私たちは果敢に科学技術を発展させる取り組みを進めており、当社の革新的なパイプラインにおける大きな進展とともに2023年度を迎えることができました。今年度の第1四半期は、当社のサイエンスに立脚した戦略、主要な成長ドライバーによる堅調な業績、商業面および事業面の持続的な進展、そして最も重要なこととして世界各国の当社の社員による献身的な努力と協力を反映しています。このような成果を成し遂げたことに大変誇りに思います。私たちは引き続き、スピード感をもって迅速に取り組み、未来を見据えて患者さんや株主の皆さんに大きな価値を届けます」と述べています。
決算サマリー
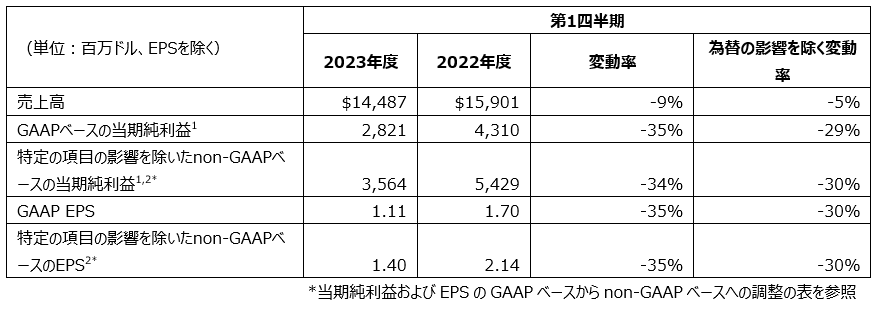
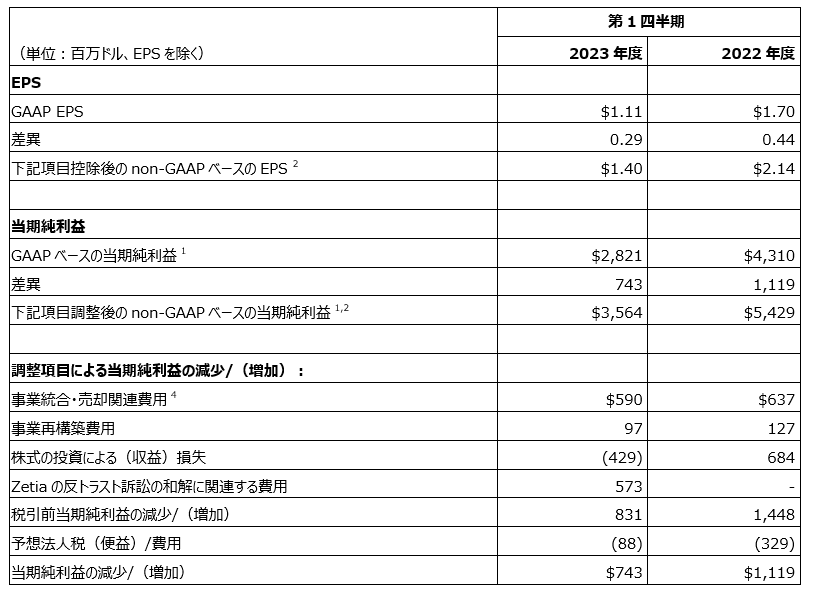
2023年度第1四半期のGAAP(GAAP:一般に公正妥当と認められる会計基準)ベースの希薄化後EPSは1.11ドルでした。2023年度第1四半期のnon-GAAPベースのEPSは1.40ドルでした。2023年度第1四半期のGAAP およびnon-GAAPベースのEPSの前年からの減少は、主にImago BioSciences, Inc.(Imago社)の買収、Kelun-Biotech社(Sichuan Kelun Pharmaceutical Co., Ltdの持株子会社)との提携およびライセンス契約に関連する負担費用0.52ドルを反映しています。また当四半期のGAAP およびnon-GAAPベースのEPSの減少は、新型コロナウイルス感染症の治療薬LAGEVRIO(モルヌピラビル)の売上高減少および為替のマイナス影響を反映しています。さらに2023年度第1四半期のGAAPベースのEPSの減少は、Zetiaの反トラスト訴訟の特定の原告との和解に関連する費用を反映しています。当四半期のGAAPベースのEPSの減少は、前年の株式の投資による損失に対して株式の投資による利益が計上されたことによるプラス影響により一部相殺されました。
non-GAAPベースのEPSは、事業統合・売却関連費用、事業再構築プログラムに関連する費用、株式の投資による収益と損失、およびZetiaの反トラスト訴訟の特定の原告との和解に関連する費用を除外しています。
免疫系パイプラインを強化するPrometheus Biosciences の買収を提案
- 2023年4月16日、Prometheus Biosciences (Prometheus社)を買収する最終契約を発表しました。子会社を通して、1株当たり200ドル、全株式概算108億ドルを現金で取得する予定です。この契約によって、免疫領域における当社のプレゼンスが高まり、潰瘍性大腸炎、クローン病などの自己免疫疾患の治療薬として新規の後期開発候補PRA023とともに、炎症性および免疫性疾患にアプローチするプレシジョン医療および標的探索を可能にするPrometheus社の網羅的データセットが加わることで当社のポートフォリオ全体に多様性をもたらします。この買収は、Prometheus社の株主の承認と一定の条件を受けて2023年度第3四半期に完了する予定です。
心血管系パイプラインハイライト
- World Heart Federation’s World Congress of Cardiologyと共同開催されたAmerican College of Cardiologyの第72回Annual Scientific Sessionで以下のデータを発表:
- 開発中の新規アクチビンシグナル伝達阻害剤のsotaterceptについて、肺動脈性肺高血圧症(PAH、WHO Group 1)の成人患者を対象とし、安定した用量で実施中の基礎療法との併用療法を評価した第3相STELLAR試験の結果を発表。Sotaterceptは、この試験の主要評価項目であるベースラインから24週時の6分間歩行距離(6MWD)を40.8メートル延長し、運動耐容能をプラセボと比較して有意に改善。さらに副次評価項目においても、臨床的な悪化または死亡のリスクの低下を含む9項目中8項目で統計学的に有意に改善。これらのデータは、The New England Journal of Medicine(NEJM)誌にも掲載。
- 高コレステロール血症の成人患者を対象に1日1回経口投与のプロタンパク質転換酵素サブチリシン/ケキシン9型(PCSK9)阻害剤として開発中のMK-0616を評価した第2b相試験の結果を発表。MK-0616の忍容性は概ね良好で、プラセボと比較してすべての用量で低比重リポタンパク質コレステロ―ル(LDL-C)が低下。これらのデータは、Journal of The American College of Cardiologyにも掲載。
オンコロジープログラムハイライト
- 当社は、KEYTRUDA(ペムブロリズマブ)に関する以下の薬事および臨床開発の進展を発表:
- II期、IIIA期、IIIB期の切除可能な非小細胞肺がん(NSCLC)患者に対する周術期療法として開発中のKEYTRUDAを評価する第3相KEYNOTE-671試験による良好な結果を発表。米国食品医薬品局(FDA)は、KEYTRUDAの生物製剤承認一部変更申請(sBLA)を受理。FDAは、処方薬ユーザーフィー法(PDUFA)の審査完了予定日を2023年10月16日に設定。
- 当社とModerna, Inc.(Moderna社)の提携のもと、第2b相KEYNOTE-942/mRNA-4157-P201試験の詳細な結果をAmerican Association for Cancer Researchの年次総会で初めて発表。KEYTRUDAと開発中の個別化ネオアンチゲン治療ワクチンmRNA-4157/V940の併用療法が、完全切除後のIII期/IV期の悪性黒色腫患者に対する術後補助療法として、KEYTRUDA単独投与と比較し、主要評価項目である無再発生存期間(RFS)について統計学的に有意でかつ臨床的に意義のある改善を示す。
- KEYTRUDAとmRNA-4157/V940の併用療法は、FDA からBreakthrough Therapy(画期的治療薬)の指定、また欧州医薬品庁(EMA)からはPriority Medicines(優先審査対象)の指定を取得。
- KEYNOTE-869試験のデータに基づき、シスプラチン含有治療が適合しない局所進行性または転移性尿路上皮がんの成人患者を対象とした、KEYTRUDAとPADCEV ®3(enfortumab vedotin-ejfv)の併用療法をFDAが迅速承認。
- III/IV期または再発子宮内膜がんの一次治療として、KEYTRUDAと化学療法との併用療法、さらに、その後の単独療法に関する第3相NRG-GY018試験の結果が米国婦人科腫瘍学会(SGO)2023 Annual Meetingで発表され、同時にNEJM誌に掲載。KEYTRUDAと化学療法の併用療法は、腫瘍のDNAミスマッチ修復機構の状態に関わらず、このような患者を対象として無増悪生存期間の有意な延長を達成。
- ヒト上皮成長因子受容体2(HER2)陰性の局所進行性切除不能または転移性胃腺がんまたは食道胃接合部腺がん患者に対する一次治療としてKEYTRUDAと化学療法の併用療法を評価したピボタル第3相KEYNOTE-859試験の結果をオンライン開催される「欧州臨床腫瘍学会(ESMO)のプレナリーセッション」で発表。KEYTRUDAと化学療法の併用療法は、PD-L1発現状況に関わらず、このような患者を対象として化学療法単独と比較して全生存期間(OS)が有意に改善。
- さらにFDAは、これらのデータに基づき、当社のsBLAを受理。FDAは、PDUFAよる期日を2023年12月16日に指定。
- 切除不能な進行または転移性の悪性胸膜中皮腫の一次治療においてKEYTRUDAと化学療法の併用療法を評価する第2/3相Canadian Cancer Trials Group(CCTG)IND.227/KEYNOTE-483試験の良好な結果を発表。
- FDAは抗がん剤諮問委員会(Oncologic Drugs Advisory Committee)を2023年4月28日に開き、転移性去勢抵抗性前立腺がんの成人患者を対象に、アビラテロンおよびプレドニゾンまたはプレドニゾロン(abi/pred)との併用療法として、Lynparza(オラパリブ)の医薬品承認事項変更申請(sNDA)を検討することを発表(主要評価項目である画像診断に基づく無増悪生存期間を含む第3相PROpel試験の結果に基づく)。またPROpel試験における主な副次評価項目としてOSの最終解析の結果も発表。
- オンコロジー領域に関する投資家向けイベントを米国臨床腫瘍学会(ASCO)年次総会で2023年6月5日月曜日、中部標準時(CT)午後6時に主催する予定。このイベントでは、上級幹部が当社のオンコロジー戦略およびプログラムに関する最新情報を提示する予定。このイベントは、米国イリノイ州シカゴで開催され、ウェブキャストでアクセス可能。ウェブキャストリンクを含めて詳細については後日、発表予定。
感染症疾患パイプラインハイライト
- HIV-1感染症の治療薬として開発中のドラビリン100 mgとイスラトラビル0.25 mgとの配合剤(DOR/ISL)の1日1回併用投与を評価する新たな第3相試験の登録を開始(HIVに関する当社の継続的な取り組みの一環)。
- 当社とギリアド社は、抗レトロウイルス療法でウイルス学的抑制が得られているHIV感染症患者を対象として、当社が開発するイスラトラビルとギリアド社が開発するlenacapavirの週1回経口併用投与レジメンを評価する第2相臨床試験を再開(改訂した治験実施計画書に基づく)。
ESG(Environment, Social, Governance:環境、社会、ガバナンス)ハイライト
- 当社は、バロンズ誌の「米国の最も持続可能な100社(Barron’s 100 Most Sustainable Companies in U.S.)」に3年連続で選出されました(製薬業界で第1位、総合では第29位)。
2023年度第1四半期の業績
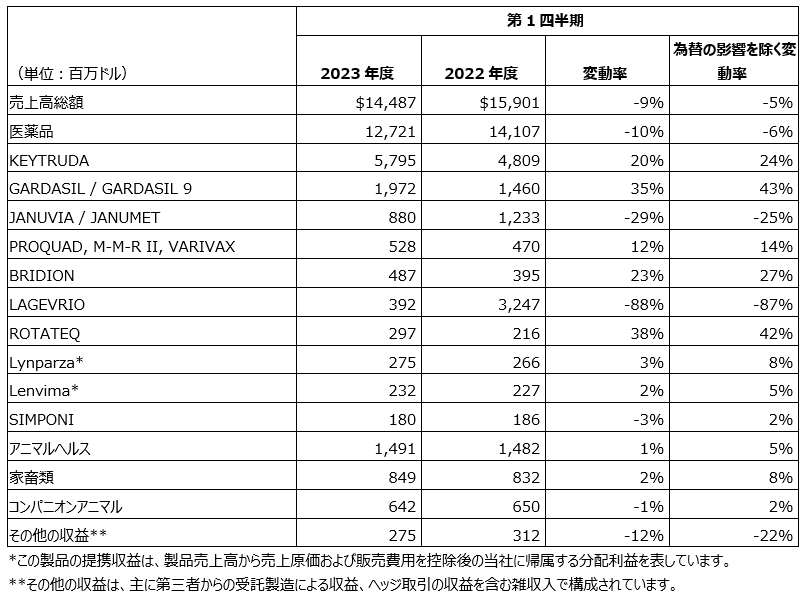
以下の表は当社の医薬品の売上高上位製品およびアニマルヘルス製品の売上高総額を表しています。
医薬品の業績
2023年度第1四半期の医薬品売上高は、10%減の127億ドルとなりました。これは主にウイルス関連製品(主にLAGEVRIO)および糖尿病領域製品の売上高減少によるものですが、オンコロジー領域、ワクチン領域および急性期治療・病院領域の成長により一部相殺されました。LAGEVRIOの売上を除けば、医薬品売上高は14%増です。またLAGEVRIOの売上およびマイナス為替の影響を除けば、医薬品売上高は18%増です。
ウイルス関連製品の売上高減少は、主にLAGEVRIOの売上高減少によるもので(88%減の3億9,200万ドル)、これは主に2022年度第1四半期の米国と英国市場の売上高が、2023年度第1四半期に再現しなかったことによるものです。またLAGEVRIOの売上高減少は、日本とオーストラリアでの売上高減少にも起因しています。
糖尿病領域における売上高の減少は、主にJANUVIA(シタグリプチン)とJANUMET(シタグリプチン/メトホルミン)の合計売上高の減少を主に反映しています。JANUVIAとJANUMETの合計売上高は、29%減の8億8,000万ドルとなりました。これは主に、複数の国際市場(特に欧州)におけるジェネリック市場競争、および米国での需要の低下および価格設定を反映しています。
オンコロジー領域の成長は、主にKEYTRUDAの売上高増加によるもので、KEYTRUDAの当四半期の売上高は前年同期比20%増の58億ドルとなりました。KEYTRUDAの世界的な売上高増加は、NSCLC、腎細胞がん、頭頸部扁平上皮がん、トリプルネガティブ乳がん(TNBC) および高頻度マイクロサテライト不安定性(microsatellite instability-high: MSI-High)固形がんの転移性の適応における力強い進展が続いていること、また米国におけるTNBCの術前/術後補助療法を含む早期がんの市場浸透を反映しています。
ワクチン領域の成長は、主にGARDASIL(組換え沈降4価 [6、11、16、18型] ヒトパピローマウイルス様粒子ワクチン)およびGARDASIL 9(組換え沈降9価ヒトパピローマウイルス様粒子ワクチン)の合計売上高の増加(35%増の20億ドル)によるものです。これは、米国以外の特に中国においての需要増加を反映していますが、出荷タイミングおよび供給増加による影響もあります。 またワクチン領域の成長は、VAXNEUVANCE(15価肺炎球菌結合型ワクチン)の売上高増加を反映しています(1億600万ドルに増加)。これは、主に米国での上市に続き、小児の適応症での継続的な市場浸透によるものです。さらにワクチン領域の売上高は、ROTATEQ(5価経口弱毒生ロタウイルスワクチン)の売上高増加を反映しています(38%増の2億9,700万ドル)。これは、主に中国における在庫確保の影響によるものです。ワクチン領域の成長は、PNEUMOVAX 23(多価肺炎球菌ワクチン)の売上高減少により一部相殺されました(44%減の9,600万ドル)。これは主に、新規の成人用肺炎球菌結合型ワクチンが使用される傾向が続き、米国での需要が減少したことを反映しています。
急性期治療・病院領域の成長は、BRIDION注射液100 mg/mL(スガマデクスナトリウム)の売上高増加を反映しています(23%増の4億8,700万ドル)。これは、主に筋弛緩回復剤のシェア拡大による需要(特に米国における)の増加によるものです。
アニマルヘルスの業績
アニマルヘルスの2023年度第1四半期の全世界での売上高は、前年同期比で1%増の15億ドルでした(為替の影響を除きアニマルヘルスの売上高は5%増)。家畜類製品の売上高成長は、特に反芻動物関連製品および養鶏関連製品のポートフォリオにおける高い需要を反映しています(テクノロジーソリューション製品、および高い価格設定を含む)。為替のマイナス影響を除けば、コンパニオンアニマル関連製品の成長は、高い価格設定による影響を反映しています。BRAVECTO(フルララネル)などの寄生虫予防薬の2023年度第1四半期の売上高は3億1,400万ドルとなりました。
2023年度第1四半期の費用に関する情報
以下の表は、費用に関する抜粋情報を表しています。
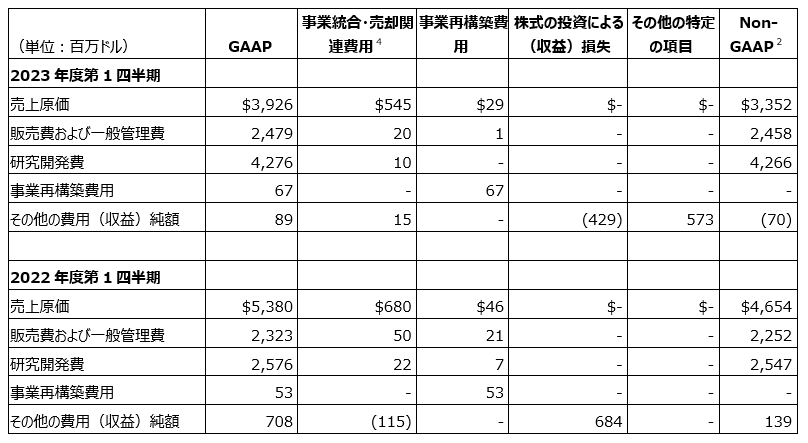
GAAPベースの費用、EPSおよび関連情報
GAAPベースでは、2023年度第1四半期の売上高総利益率は72.9%で、2022年度第1四半期では66.2%でした。この増加は主に、売上高総利益率が低いLAGEVRIOの売上高減少、プロダクト・ミックスのプラス影響および無形資産の償却費の減少を反映しています。
2023年度第1四半期の販売費および一般管理費は、前年同期比で7%増の25億ドルでした。この増加は主に、管理費の増加および販売促進費の増加を反映していますが、為替のプラス影響により一部相殺されました。
2023年度第1四半期の研究開発費は、前年同期比で66%増の43億ドルでした。この増加は主に、Imago社の買収に関連する費用12億ドル、Kelun-Biotech社との提携およびライセンス契約に関連する負担費用1億7,500万ドルを反映しています。さらに、この増加は、報酬および福利厚生費用の増加(臨床開発活動の拡大を支える人員の部分的な増加を反映)、開発候補品の発見と初期の医薬品開発への投資の増加、ならびに臨床開発費の増加も反映しています。
2023年度第1四半期のその他の費用(収益)純額は、2022年度第1四半期の7億800万ドルの費用に対し8,900万ドルの費用を計上しました。2023年度第1四半期におけるその他の費用(収益)純額の変動は主に、2022年第1四半期の株式の投資による損失に対して2023年第1四半期は株式の投資による利益が計上されこと、ならびに2023年第1四半期の金利収入の増加を反映しています。このプラス影響は、Zetiaの反トラスト訴訟の特定の原告との和解に関連する費用5億7,300万ドル(2023年第1四半期)により一部相殺されました。
2023年度第1四半期の実効税率は22.6%となり、Imago社の買収に関連する費用に税務優遇が適用されなかったことによる個別のマイナス影響、外国税額の増加、Tax Cuts and Jobs Act(2017米国税制改革)による研究開発費に対する資本化引当および株式の投資による未実現純利益(米国税率によって課税されました)によるマイナス影響を反映しています。
2023年度第1四半期のGAAPベースのEPSは1.11ドル、2022年度第1四半期では1.70ドルでした。
non-GAAPベースの費用、EPSおよび関連情報
non-GAAPベースの売上高総利益率は、2022年度第1四半期の70.7%に対し2023年度第1四半期は76.9%でした。この増加は主に、売上高総利益率が低いLAGEVRIOの売上高減少、プロダクト・ミックスのプラス影響を反映しています。
2023年度第1四半期のnon-GAAPベースの販売費および一般管理費は、前年同期比で9%増の25億ドルでした。この増加は主に、管理費の増加および販売促進費の増加を反映していますが、為替のプラス影響により一部相殺されました。
2023年度第1四半期のnon-GAAPベースの研究開発費は、前年同期比で67%増の43億ドルでした。この増加は主に、Imago社の買収に関連する費用12億ドル、Kelun-Biotech社との提携およびライセンス契約に関連する負担費用1億7,500万ドルを反映しています。さらに、この増加は、報酬および福利厚生費用の増加(臨床開発活動の拡大を支える人員の部分的な増加を反映)、開発候補品の発見と初期の医薬品開発への投資の増加、ならびに臨床開発費の増加も反映しています。
non-GAAPベースでの2023年度第1四半期のその他の費用(収益)純額は、2022年度第1四半期の1億3,900万ドルの費用に対し7,000万ドルの収益を計上しました。この変動は主に、2023年第1四半期の金利収入の増加を反映しています。
2023年度第1四半期のnon-GAAPベースの実効税率は22.6%となり、Imago社の買収に関連する費用に税務優遇が適用されなかったことによるマイナス影響、外国税額の増加およびTax Cuts and Jobs Act(2017米国税制改革)による研究開発費に対する資本化引当によるマイナス影響を反映しています。
2023年度第1四半期のnon-GAAPベースのEPSは1.11ドル、2022年度第1四半期では1.70ドルでした。
当期純利益およびEPSのGAAPベースからnon-GAAPベースへの調整は、以下の表のとおりです。
業績見通し
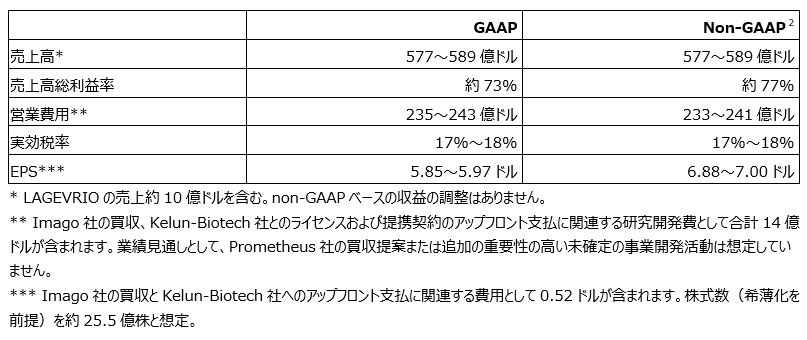
以下の表は、当社の2023年通期の業績見通しの要約を表しています。
当社は、主要な成長領域において世界的に堅調な潜在需要を取り込み続けています。そのため当社は、通期の業績見通しおよびnon-GAAPベースのEPSを上方修正しました。GAAPベースのEPSについては、通期の業績見通しを下方修正しました。これは、Zetiaの反トラスト訴訟の特定の原告との和解に関連する費用(GAAPベースのみ)が起因しています。
当社は、2023年4月中旬の為替を基準として、為替のマイナス影響約2%ポイントを含み、2023年度通期の売上高を577億ドル~589億ドルになると予想しています。2023年通期の業績見通しには、LAGEVRIOの予測売上高約10億ドルが含まれます。
2023年度通期の実効税率は17%~18%になると予想しています。
当社は、2023年度通期のGAAPベースのEPSレンジを5.85ドル~5.97ドルに下方修正しています。
2023年度通期のnon-GAAPベースのEPSレンジを6.88ドル~7.00ドルに上方修正しています(2023年4月中旬の為替を基準として為替のマイナス影響約4%ポイントを含む)。またnon-GAAPレンジでは、事業統合・売却関連費用、事業再構築プログラムに関連する費用、株式の投資による収益と損失、Zetiaの反トラスト訴訟の特定の原告との和解に関連する費用を除外しています。
2023年度のGAAPベースの予想EPSからnon-GAAPベースのEPSへの調整、およびnon-GAAPベースのEPSからの控除項目は以下の表のとおりです。

2023年4月、当社はPrometheus社の買収に合意したことを発表しました。この買収は、2023年度第3四半期に完了する予定です。今回の業績見通しには、この買収による影響を反映しておりませんが、資産の買収として、2023年年度のGAAPおよびnon-GAAPベースの研究開発費に、約103億ドルの費用を一括計上する予定です(一株当たり約4.00ドル)。さらにパイプライン資産を推進するための運用投資、および資金調達コストを考慮すると、この買収が完了してからの12カ月間において、EPSは約0.25ドルのマイナス影響を受けると予想しています。この取引が完了次第、当社のGAAPおよびnon-GAAPベースの業績見通しに、この買収による影響予測を反映する予定です。
Merck & Co., Inc., Rahway, N.J., USAについて
Merck & Co., Inc., Rahway, N.J., USA(米国とカナダ以外ではMSD)は、最先端のサイエンスを駆使して、世界中の人々の生命を救い、生活を改善するというパーパスのもとに結束しています。130年以上にわたり、重要な医薬品やワクチンの発見を通して人類に希望をもたらしてきました。私たちは、世界トップクラスの研究開発型バイオ医薬品企業を目指し、人類や動物の疾患予防や治療に寄与する革新的なヘルスケア・ソリューションを提供するために、研究開発の最前線で活動しています。私たちは、多様かつ包括的な職場環境を醸成し、世界中の人々と地域社会に、安全で持続可能かつ健康な未来をもたらすため、責任ある経営を日々続けています。詳細については、当社ウェブサイトやTwitter、Facebook、Instagram、YouTube、LinkedInをご参照ください。
Merck & Co., Inc., Rahway, N.J., USAの将来に関する記述
このニュースリリースには、米国の1995年私的証券訴訟改革法(the Private Securities Litigation Reform Act of 1995)の免責条項で定義された「将来に関する記述」が含まれています。これらの記述は、Merck & Co., Inc., Rahway, N.J., USAの経営陣の現時点での信条と期待に基づくもので、相当のリスクと不確実性が含まれています。新薬パイプラインに対する承認取得またはその製品化による収益を保証するものではありません。予測が正確性に欠けていた場合またはリスクもしくは不確実性が現実化した場合、実際の成果が、将来に関する記述で述べたものと異なる場合も生じます。
リスクと不確実性には、業界の一般的な状況および競争環境、金利および為替レートの変動などの一般的な経済要因、昨今の新型コロナウイルス感染症(COVID-19)の世界的大流行の影響、米国および世界における医薬品業界の規制やヘルスケア関連の法制度が及ぼす影響、ヘルスケア費用抑制の世界的な傾向、競合他社による技術的進歩や新製品開発および特許取得、承認申請などの新薬開発特有の問題、Merck & Co., Inc., Rahway, N.J., USAによる将来の市況予測の正確性、製造上の問題または遅延、国際経済および政府の信用リスクなどの金融不安、革新的製品に対するMerck & Co., Inc., Rahway, N.J., USAの特許権やその他の保護の有効性への依存、特許訴訟や規制措置の対象となる可能性等がありますが、これらに限定されるものではありません。
Merck & Co., Inc., Rahway, N.J., USAは、新たな情報、新たな出来事、その他いかなる状況が加わった場合でも、将来に関する記述の更新を行う義務は負いません。将来に関する記述の記載と大きく異なる成果を招くおそれがあるこの他の要因については、Merck & Co., Inc., Rahway, N.J., USAに関するForm 10-Kの2022年度年次報告書および米国証券取引委員会(SEC)のインターネットサイト(www.sec.gov)で入手できるSECに対するその他の書類で確認できます。
1Merck & Co., Inc., Rahway, N.J., USAに帰属する当期純利益
2Merck & Co., Inc., Rahway, N.J., USAは、事業業績や傾向に関する分析への特定項目の性質による影響を考慮し、2023年度および2022年度の特定の項目の影響を除いたnon-GAAPベースの情報を提供しています。経営陣は、non-GAAPベースの決算報告を用いて業績を評価しているため、この情報が会社の決算結果の理解を深めるものと考えています。経営陣は、non-GAAPベースの指標を目標の設定や達成予測のため、またその他の基準で当社の業績を評価するために社内的に活用します。加えて、上級管理職の年間報酬の一部はnon-GAAPベースの税引前利益から支払われています。これはGAAPに基づき算出された情報に関する追加情報であって、その代わりとなるものではなく、また優先されるものでもありません。non-GAAPベースの調整についての詳細は、本報告書に添付された表2a(脚注を含む)を参照してください。
3Seagen社およびAgensys社の登録商標です。
4事業統合・売却に関する統合費用、取引費用およびその他の費用と共に、買収の結果、認識された無形資産の償却費および棚卸資産に対するパーチェス法適用に伴う調整額、無形資産の減損損失、および、条件付対価による負債の公正価値測定の見積り変更に関連する費用または収益が含まれます。
# # #
MSDについて
MSD(Merck & Co., Inc., Rahway, N.J., USAが米国とカナダ以外の国と地域で事業を行う際に使用している名称)は、最先端のサイエンスを駆使して、世界中の人々の生命を救い、生活を改善するというパーパスのもとに結束しています。130年以上にわたり、重要な医薬品やワクチンの発見を通して人類に希望をもたらしてきました。私たちは、世界トップクラスの研究開発型バイオ医薬品企業を目指し、人類や動物の疾患予防や治療に寄与する革新的なヘルスケア・ソリューションを提供するために、研究開発の最前線で活動しています。私たちは、多様かつ包括的な職場環境を醸成し、世界中の人々と地域社会に、安全で持続可能かつ健康な未来をもたらすため、責任ある経営を日々続けています。MSDの詳細については、弊社ウェブサイト(www.msd.co.jp)やFacebook、Twitter、YouTube、LinkedInをご参照ください。