抗サイトメガロウイルス化学療法剤「プレバイミス®」小児に対する用法及び用量ならびに剤形追加の承認を取得
2025/03/27 15:00 JST
報道関係各位
MSD株式会社
MSD株式会社(本社:東京都千代田区、代表取締役社長:カイル・タトル、以下「MSD」)は、本日、抗サイトメガロウイルス化学療法剤「プレバイミス®」(一般名:レテルモビル)について、「プレバイミス®錠240mg」および「プレバイミス®点滴静注240mg」の日本国内における小児に対する用法及び用量の製造販売承認事項一部変更承認、ならびに小児でも利用可能な経口剤として「プレバイミス®顆粒分包20mg」および「プレバイミス®顆粒分包120mg」の製造販売承認をそれぞれ取得しましたのでお知らせいたします。
サイトメガロウイルス(CMV)は、一般的には不顕性感染として無症状で経過します。しかし、病気や薬の使用などによって免疫系が抑制されている状態下では、体内に潜伏していたCMVの再活性化や新たな感染により、腸炎、肺炎、網膜炎などの重篤なCMV感染症を引き起こして、死に至るケースもあります*1,*2 。同種造血幹細胞移植や臓器移植を受けた患者さんは、免疫力が著しく低下していることからCMV感染症を発症するリスクが高く、そのことが移植後の死亡率の増加や長期予後に関わっていると報告されています*1, *2。小児の移植患者さんでも、成人と同様にCMV感染症のリスクに曝されており、新たな薬剤の開発が求められています。
*1: 一般社団法人日本移植学会「臓器移植関連CMV感染症診療ガイドライン2022」2022年11月
*2: 一般社団法人日本造血・免疫細胞療法学会「造血細胞移植ガイドライン ウイルス感染症の予防と治療 サイトメガロウイルス感染症(第5版補訂版)」2024年9月
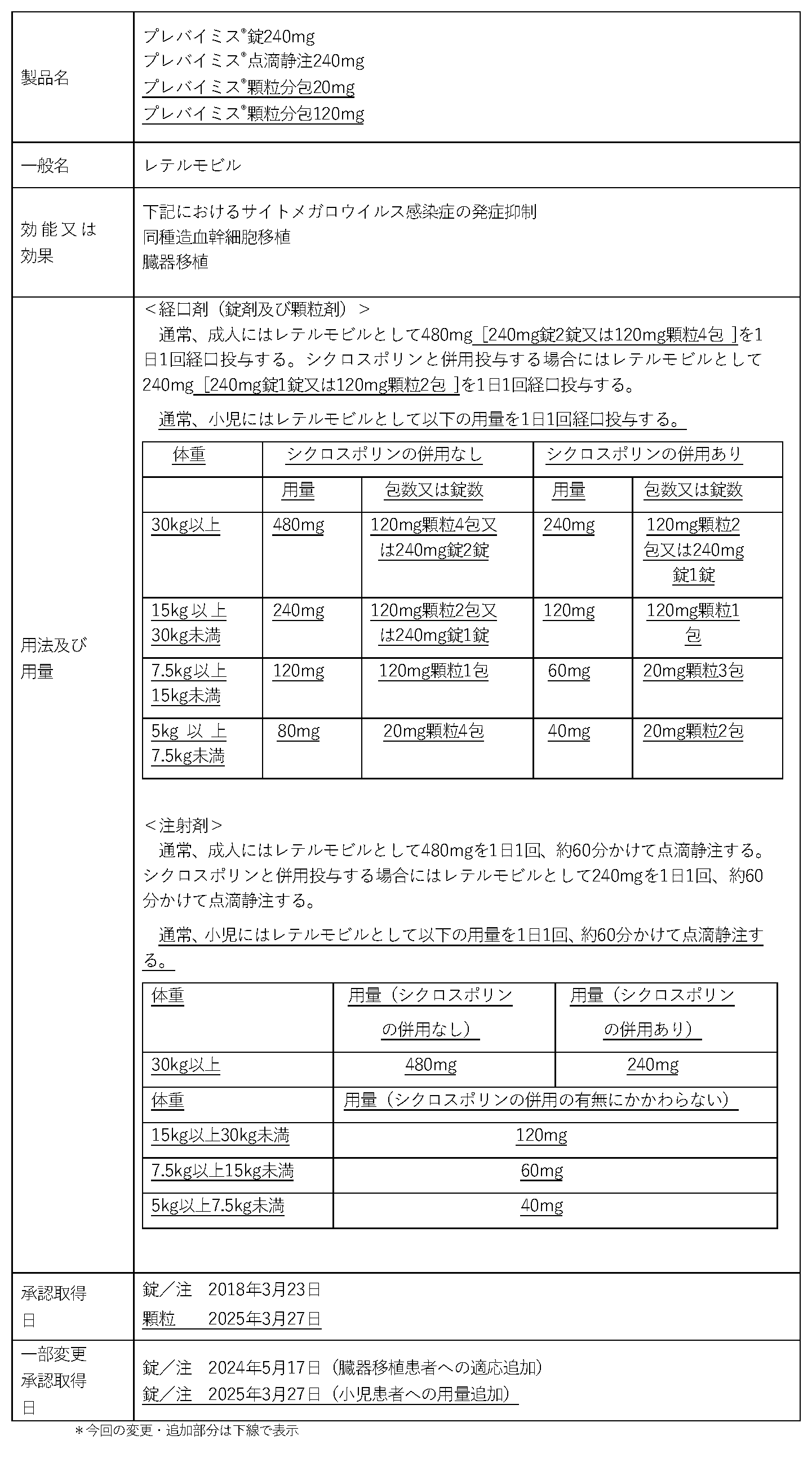
「プレバイミス®」は、ヒトには存在しないCMVのDNAターミナーゼを阻害することでウイルスの増殖を抑制するCMVターミナーゼ阻害剤で、成人を対象に「同種造血幹細胞移植及び臓器移植におけるサイトメガロウイルス感染症の発症抑制」での適応を取得しています。今回の承認は、CMV 感染および感染症リスクを有する、0歳から18 歳未満の小児同種造血幹細胞移植患者(治験薬投与を受けた患者 63 例、うち日本人患者 4 例)を対象に、レテルモビルを移植後28日以内から移植後14週まで投与した際の薬物動態、CMV 感染症の発症抑制効果および安全性を検討することを目的として実施した、単群非盲検試験(030 試験)の結果などに基づいています。
今回の承認により追加された顆粒剤は、小型の粒状のフィルムコーティング剤であり、小児でも飲みやすい剤形です。1包あたりレテルモビル20mgおよび120mgの2種類の規格があることから、複数包を使用することで、体重5kg以上の小児へ体重区分に応じた用量での投与が可能となるとともに、患者さんの状況に応じた剤形選択が可能となり、より一層、CMV感染症への対策に貢献できるものと考えております。
MSDは、今後も感染症予防および治療における医療ニーズに応えていけるよう、革新的な医薬品の開発に引き続き取り組んでまいります。
以上
MSDについて
MSD(Merck & Co., Inc., Rahway, NJ, USAが米国とカナダ以外の国と地域で事業を行う際に使用している名称)は、「最先端のサイエンスを駆使して、世界中の人々の生命を救い、生活を改善する」というパーパスのもとに結束し、130年以上にわたり、重要な医薬品やワクチンの開発を通して人類に希望をもたらしてきました。私たちは、世界トップクラスの研究開発型バイオ医薬品企業を目指し、人類や動物の疾患予防や治療に寄与する革新的なヘルスケア・ソリューションを提供するために、研究開発の最前線で活動しています。また、私たちは、多様かつ包括的な職場環境を醸成し、世界中の人々と地域社会に安全で持続可能かつ健康な未来をもたらすため、責任ある経営を日々行っています。MSDの詳細については、弊社ウェブサイト(www.msd.co.jp)やFacebook、Instagram、YouTubeをご参照ください。
参考資料