MSD株式会社 MRSA感染症治療薬「キュビシン®」の小児に対する用法及び用量の追加承認取得に関するお知らせ
2022/06/20 00:00 JST
報道関係各位
MSD株式会社
MSD株式会社(本社:東京都千代田区、代表取締役社長:カイル・タトル、以下 「MSD」)は、本日、メチシリン耐性黄色ブドウ球菌(Methicillin-resistant Staphylococcus aureus, 以下MRSA)感染症の治療薬「キュビシン®静注用350mg」(一般名:ダプトマイシン、以下「キュビシン®」)について、小児に対する用法及び用量を追加する製造販売承認事項一部変更承認を取得しました。
「キュビシン®」は他の抗MRSA薬とは異なる作用機序で、グラム陽性菌の細胞膜にカルシウムイオン濃度依存的に結合及び浸透し、細胞膜中でオリゴマーを形成(ミセル化)して、膜電位の脱分極を引き起こし、カリウムイオンを流出させます。その結果、蛋白質、DNA及びRNAの合成を阻害し、溶菌を引き起こすことなく細菌が死滅します。1)-5) さらに、TDM(薬物治療モニタリング)の必要がなく、1日1回投与による敗血症、深在性皮膚感染症、外傷・熱傷及び手術創等の二次感染、びらん・潰瘍の二次感染を適応症とする抗MRSA薬として、小児患者に対する新たな治療選択肢になり得ると考えております。
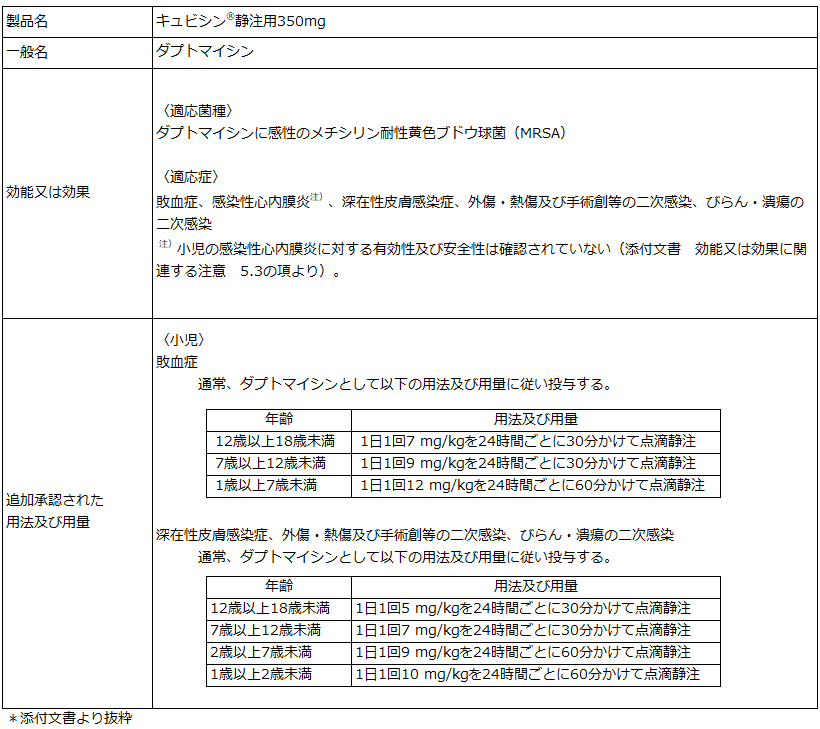
本承認は、国内外の小児患者(1歳以上17歳以下)を対象とした臨床試験のデータ等に基づいています。日本では、グラム陽性球菌による複雑性皮膚・軟部組織感染症又は菌血症の1~17歳の日本人小児患者を対象に多施設共同第2相試験(029試験)が行われ、MITT(Modified Intention to Treat)のうち組み入れ時にMRSA感染が確認された集団(MITT-MRSA)患者における治癒判定時の臨床効果は、複雑性皮膚・軟部組織感染症では7例中6例が有効と判定され、同様に菌血症では、1例中1例が有効と判定されました。報告された副作用は、複雑性皮膚・軟部組織感染症及び菌血症において、18例中2例に認められ、複雑性皮膚・軟部組織感染症では、14例中1例に血小板数増加、菌血症では、4例中1例に注入部位腫脹が認められました。本試験において、死亡、重篤な有害事象及び投与中止に至った有害事象は認められませんでした。
2022年2月現在、「キュビシン®」は小児に対して、グラム陽性球菌による複雑性皮膚・軟部組織感染症又はStaphylococcus aureus (黄色ブドウ球菌)による血流感染による菌血症に対する治療薬として米国及びEUを含む50以上の国又は地域で使用されております。
MSDは、今後も感染症予防と治療に貢献し、これまで以上に医療ニーズに応えていきたいと考えています。
1)Silverman JA, et al., Antimicrob Agents Chemother. 2003;47(8):2538-2544.
2)Canepari P, et al., Antimicrob Agents Chemother. 1990;34(6):1220-1226.
3)Laganas V, et al., Antimicrob Agents Chemother. 2003;47(8):2682-2684.
4)Hobbs JK, et al., J Antimicrob Chemother. 2008;62(5):1003-1008.
5)社内資料:効力を裏付ける試験
以上
<参考資料>
環状リポペプチド系抗生物質製剤 注射用ダプトマイシン 「キュビシン®静注用350mg」
MSDについて
MSD(Merck & Co., Inc., Rahway, NJ, U.S.A.が米国とカナダ以外の国と地域で事業を行う際に使用している名称)は、最先端のサイエンスを駆使して、世界中の人々の生命を救い、生活を改善するというパーパスのもとに結束しています。130年以上にわたり、重要な医薬品やワクチンの発見を通して人類に希望をもたらしてきました。私たちは、世界トップクラスの研究開発型バイオ医薬品企業を目指し、人類や動物の疾患予防や治療に寄与する革新的なヘルスケア・ソリューションを提供するために、研究開発の最前線で活動しています。私たちは、多様かつ包括的な職場環境を醸成し、世界中の人々と地域社会に、安全で持続可能かつ健康な未来をもたらすため、責任ある経営を日々続けています。MSDの詳細については、弊社ウェブサイト(www.msd.co.jp)や Facebook 、 Twitter 、 YouTubeをご参照ください。
