Merck & Co., Inc., Kenilworth, N.J., U.S.A. 2021年度第3四半期決算発表
November 16, 2021 12:00 am ET
報道関係各位
MSD株式会社
この参考資料は、Merck & Co., Inc., Kenilworth, N.J., U.S.A.が2021年10月28日付(米国東部時間)で発表した2021年度第3四半期決算のプレスリリースMerck Announces Third-Quarter 2021 Financial Resultsを日本語に翻訳したもので、内容および解釈については英語が優先されます。
以下の医療用医薬品は、日本国内で発売しております。カナ表記は括弧内をご参考ください。BRIDION®(ブリディオン®)、GARDASIL®(ガーダシル®)、ISENTRESS®(アイセントレス®)、JANUVIA®(ジャヌビア®)、KEYTRUDA®(キイトルーダ®)、Lenvima®(レンビマ®)、Lynparza®(リムパーザ®)、PREVYMIS®(プレバイミス®)、ROTATEQ®(ロタテック®)、ZERBAXA®(ザバクサ®)
参考資料
Merck & Co., Inc., Kenilworth, N.J., U.S.A.
2021年度第3四半期決算発表
- 事業全体において当期業績は力強い進展を達成
- 2021年度第3四半期の全世界売上高は、前年同期比20%増の132億ドル(為替の影響を除き19%増)。当社の堅固なポートフォリオに対する堅調な需要を反映:
- KEYTRUDAの売上高は、22%の成長で45億ドル(為替の影響を除き21%増)
- GARDASIL/GARDASIL 9の売上高は、68%の成長で20億ドル(為替の影響を除き63%増)
- アニマルヘルスの売上高は、16%の成長で14億ドル(為替の影響を除き14%増)
- 2021年度第3四半期のGAAPベースのEPSは1.80ドル(継続的事業活動に基づく)、non-GAAPベースでは1.75ドル(継続的事業活動に基づく)
- Acceleron Pharma社の買収に関する契約を締結しイノベーションを促進(当社の心血管系パイプラインの補強および拡大)
- 薬事申請の進捗、複数の承認取得および重要な政府推奨の進展:
- 軽症から中等症の新型コロナウイルス感染症の重症化リスク因子を有する患者を対象とする経口抗ウイルス薬として開発中のモルヌピラビルの緊急使用許可をFDAに申請
- フォン・ヒッペル-リンドウ病に伴う特定の腫瘍を有する成人患者に対する治療候補薬である、WELIREGをFDAが承認
- 進行性腎細胞がんの成人患者に対する一次治療としてKEYTRUDAとLenvimaの併用療法をFDAが承認
- 治療抵抗性、再発または転移性子宮頸がん患者に対するKEYTRUDAと化学療法±ベバシズマブの併用療法をFDAが承認
- 米国CDCの予防接種諮問委員会は、65歳以上および特定の基礎疾患を有する19歳から64歳までの成人に対する治療選択肢として、VAXNEUVANCEに続きPNEUMOVAX 23を投与する連続接種レジメンを暫定的に推奨することを表明。
- 2021年業績見通し:
- 2021年度通期の収益を474億ドル~479億ドルに上方修正(為替のプラス影響約1.5%を含む)。2021年度通期の売上高成長を14%~15%と予想。
- 2021年度通期のGAAPベースのEPSレンジを4.71ドル~4.76ドルに上方修正、2021年度通期のnon-GAAPベースのEPSレンジを5.65ドル~5.70ドルに上方修正(為替のプラス影響約2%を含む)
米国ニュージャージー州ケニルワース– Merck & Co., Inc., Kenilworth, N.J., U.S.A.(米国とカナダ以外ではMSD)は2021年10月28日、2021年度第3四半期の決算を発表しました。
最高経営責任者(CEO)兼社長ロバート・M・デイビスは、「当期も勢いをもって事業を進め、パイプラインの有意義な進展とともに堅調な四半期決算を達成しました。当社のチームは、当社の優れたサイエンスを象徴する研究所においてイノベーションを推進すると同時に、事業的な発展に注力し、引き続き、卓越した業績を達成しています。私たちは、モルヌピラビルによる第3相試験の良好な結果など新型コロナウイルス感染症およびオンコロジー領域の主要な分野における臨床開発で大きなマイルストーンを達成しました。さらに、Acceleron社の買収提案を発表しました。この買収は、最先端のサイエンスと有望な後期開発候補をもたらし、当社の心血管系パイプラインを補強します。これからも将来を見据えて、さらなる進展に注力し、人々の生命を救い生活を改善するという私たちのミッションを果たすために、また長期的な成功と持続可能な価値の創出を実現させるために、ポートフォリオとパイプラインの拡充に取り組みます」と述べています。
決算サマリー(継続的事業活動に基づく)
本リリースで提示される決算情報は、2021年6月2日に分社化が完了したOrganon & Co.の業績を除外した継続的事業活動に基づく当社の業績を反映しています。
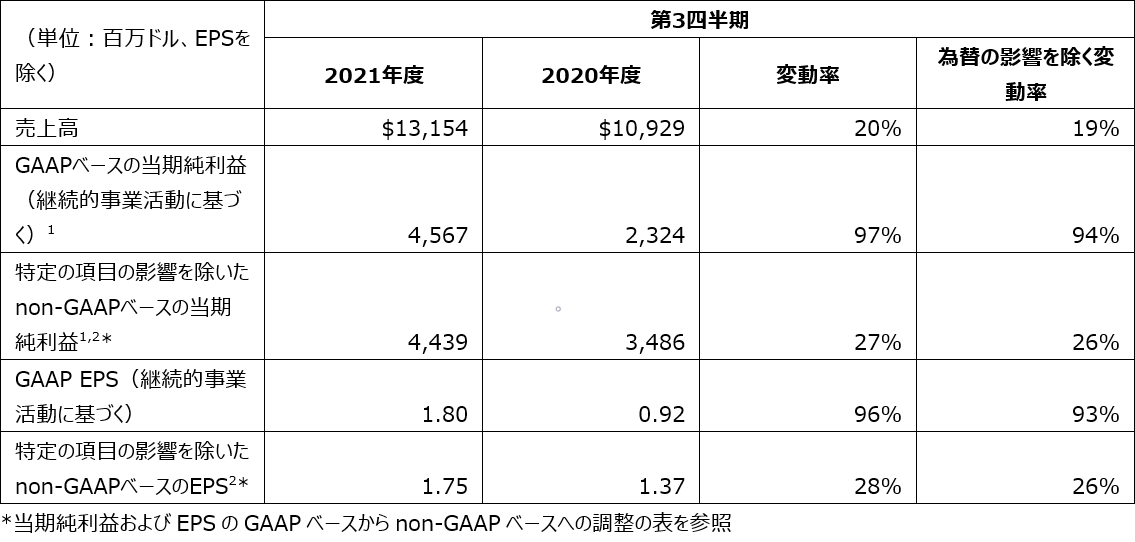
2021年度第3四半期のGAAP(GAAP:一般に公正妥当と認められる会計基準)ベースの希薄化後EPSは1.80ドルでした。2021年度第3四半期のnon-GAAPベースのEPSは1.75ドルで、事業統合・売却関連費用、事業再構築費用、株式の投資による収益と損失、および特定のその他の項目を除外しています。
事業全体において堅調な業績パフォーマンス
オンコロジー、ワクチン、アニマルヘルス領域などの主要な分野における堅調な業績を達成しました。これらの業績をもたらした革新的な製品には、KEYTRUDA(ペムブロリズマブ)、Lynparza(オラパリブ)、Lenvima(レンバチニブメシル酸塩)、GARDASIL(組換え沈降4価 [6、11、16、18型] ヒトパピローマウイルス様粒子ワクチン)、GARDASIL 9(組換え沈降9価ヒトパピローマウイルス様粒子ワクチン)、およびBRAVECTO(フルララネル)などが含まれます。またBRIDION注射液100 mg/mL(スガマデクスナトリウム)は、当四半期、力強い成長を達成しました。当社は引き続き、当社製品による堅調な潜在需要、さらに世界各国における幅広い商業スケールと当社の革新的な製品に対する患者アクセスの向上による恩恵を受けています。
新型コロナウイルス感染症に対する経口抗ウイルス薬として開発中のモルヌピラビルによる第3相試験の良好な結果を報告
当社とRidgeback Biotherapeuticsは、重症化や入院のリスク因子を有する、軽症から中等症の新型コロナウイルス感染症の入院していない成人患者を対象として、経口抗ウイルス薬として開発中のモルヌピラビル(MK-4482、EIDD-2801)を評価する第3相MOVe-OUT試験の中間解析の良好な結果を発表しました。この結果に基づき、2021年10月11日、当社は米国食品医薬品局(FDA)に緊急使用許可(EUA)の申請を提出し、世界各国の規制当局にも承認申請を提出する計画です。モルヌピラビルが承認を取得すれば、新型コロナウイルス感染症のパンデミックとの戦いに対する国際的な取り組みの一環としてモルヌピラビルは重要な治療薬になると期待しています。2021年10月14日、FDAは、抗菌薬諮問委員会(Antimicrobial Drugs Advisory Committee)が軽症から中等症の新型コロナウイルス感染症の重症化リスク因子を有する成人患者を対象とする治療薬として開発中のモルヌピラビルの使用を裏付けるデータに関する協議を2021年11月30日に行うことを発表しました。2021年10月25日、欧州医薬品庁(EMA)は、成人患者を対象とする治療薬として開発中のモルヌピラビルに関する逐次審査を開始しました。当社はEMAの医薬品委員会(CHMP)とともに、モルヌピラビルの販売承認申請の正式な審査を迅速に開始させるため、この逐次審査の完了に向けて取り組む予定です。
当社はモルヌピラビルの許可や承認を取得できた場合、世界中で速やかに本剤を提供していきたいと考えており、世界銀行による国の所得基準に基づき、新型コロナウイルス感染症のパンデミックの公衆衛生対策および医療制度における各国の相対的な経済力に応じて段階的な価格設定を採用する計画です。実績のあるインドのジェネリックメーカー数社とモルヌピラビルの非独占的で社会貢献的なライセンス契約を締結しました。また当社と医薬品特許プール(MPP)は、各国の薬事当局においてモルヌピラビルのジェネリックへのアクセスを促進させる社会貢献的なライセンス契約を締結したことを共同で発表しました。これらの契約によって、世界100カ国以上の低・中所得国でモルヌピラビルのアクセスを拡大できるようになります。
当社は、オーストラリア、ニュージーランド、韓国、英国および米国(承認審査中)など複数の政府とモルヌピラビルを供給する調達契約を締結しました。また、その他政府とも協議を進めています。当社では、2021年末までに1000万治療コース分を生産できる見込みで、2022年はさらに少なくとも2000万治療コース分を生産する予定です。
Acceleron社を買収予定、イノベーションの促進および心血管系パイプラインの拡大
当社は、Acceleron Pharma Inc.(Acceleron社)を買収する株式公開買付および最終契約を発表しました。このAcceleron社の買収提案は、リード開発候補薬のsotaterceptをもたらし、当社の心血管系パイプラインを補強します。sotaterceptは、ファーストインクラスの肺高血圧症治療候補薬として第3相臨床試験にて開発中です。当社は、2021年10月12日に株式公開買付を開始し、買付の完了および必要な承認取得を目指します。子会社を通して Acceleron社の概算の全株式115億ドルを1株当たり180ドルの現金で取得する予定です。この買収は、2021年度第4四半期に完了する予定です。
オンコロジープログラムハイライト
当社は、オンコロジーにおける開発プログラムを引き続き進展させ、2028年までに90種類を超える新規の適応取得を予定しています。この中には、抗PD-1抗体KEYTRUDA、アストラゼネカ社との共同開発・商業化を進める経口ポリ(ADP-リボース)ポリメラーゼ(PARP)阻害剤Lynparza、エーザイ社と共同開発・商業化を進める経口チロシンキナーゼ阻害剤(TKI)Lenvima、および経口低酸素誘導因子2アルファ(HIF-2α)阻害剤WELIREG(belzutifan)などが含まれます。
- 主な薬事上の進展は以下のとおりです:
- 非盲検004試験の結果に基づき、即時手術を必要としない、フォン・ヒッペル-リンドウ病に伴う腎細胞がん(RCC)、中枢神経系血管芽細胞腫または膵神経内分泌腫瘍の成人患者に対する治療薬として、WELIREGをFDAが承認。WELIREGは、米国で初めて承認されたHIF-2α阻害剤であり、単剤療法および他の新規治療薬との併用療法として3件の第3相試験にて現在評価中。
- 第3相CLEAR試験(KEYNOTE-581試験/ 307試験)の結果に基づき、進行性RCCの成人患者に対する一次治療としてKEYTRUDAと Lenvimaの併用療法をFDAが承認。
- 第3相KEYNOTE-826試験の結果に基づき、KEYTRUDAと化学療法±ベバシズマブとの併用療法が、FDAの承認する検査でPD-L1陽性(Combined Positive Score [CPS]≧1)と確認された治療抵抗性、再発または転移性子宮頸がんを適応症としてFDAの承認を取得。
- 腎摘除術後または腎摘除術および転移巣切除術後の再発リスクが中~高度(intermediate-high)または高度(high)のRCC患者に対する術後補助療法として、KEYTRUDAの新たな生物学的製剤承認一部変更申請(sBLA)をFDAが優先審査に指定。このsBLAは、プラセボと比較して、統計的に有意で臨床的に意味のある無病生存期間の改善を達成した第3相KEYNOTE-564試験のデータに基づく。処方薬ユーザーフィー法(Prescription Drug User Fee Act, PDUFA)による審査終了目標日は、2021年12月10日。
- 完全切除後のIIB期またはIIC期悪性黒色腫の成人患者および小児患者(12歳以上)の術後補助療法としてKEYTRUDAの新規のsBLAをFDAが優先審査に指定。このsBLAは、プラセボと比較して、統計的に有意で臨床的に意味のある無再発生存期間の改善を示した第3相KEYNOTE-716試験のデータに基づく。PDUFAによる審査終了目標日は、2021年12月4日。
- 全身療法後に増悪した、根治的手術または放射線療法に不適応な高頻度マイクロサテライト不安定性(MSI-High)またはミスマッチ修復機能欠損(dMMR)を有する進行性子宮内膜がん(EC)に対するKEYTRUDAの単剤療法の承認を求める新規のsBLAをFDAが審査。この申請は、KEYNOTE-158試験のコホートDおよびKの全奏効データに基づく。PDUFAによる審査終了目標日は、2022年3月28日。
- 転移性疾患に対する化学療法の治療歴がない、腫瘍にPD-L1の発現が認められる(CPS≧10)切除不能の局所再発または転移性トリプルネガティブ乳がん(TNBC)成人患者に対するKEYTRUDAと化学療法との併用療法に関してEMAのCHMPが肯定的見解を発表。この肯定的見解は、第3相KEYNOTE-355試験の無増悪生存期間および全生存期間(OS)に基づく。
- 転移性疾患に対する化学療法の治療歴がない、腫瘍にPD-L1の発現が認められる(CPS≧10)切除不能の局所再発または転移性TNBC成人患者に対する一次治療としてのKEYTRUDAと化学療法との併用療法を欧州委員会が承認。
- 進行性RCCと進行・再発ECの2つの適応症に対するKEYTRUDAとLenvimaの併用療法に関してEMAのCHMPが承認を勧告する肯定的見解を発表。この肯定的見解は、2件の第3相試験のデータに基づく:進行性RCCの成人患者を対象に併用療法を評価するCLEAR試験(KEYNOTE-581試験/ 307試験)、および進行・再発ECの特定の患者を対象に併用療法を評価するに対するKEYNOTE-775試験/ 309試験。
- 局所進行で切除不能または転移性の食道がんまたは胃食道接合部がん患者の一次治療としてKEYTRUDAとプラチナ製剤およびフッ化ピリミジン系製剤ベースの化学療法との併用療法を中国国家医薬品管理局(National Medical Products Administration)が承認。この新規の適応症は、第3相KEYNOTE-590試験のOSに関する結果に基づき取得。現在、KEYTRUDAは、中国で5種類のがんに8つの適応症の承認を取得。
- 日本の医薬品医療機器総合機構では、KEYTRUDAの2つの適応症を承認。KEYTRUDAは、第3相KEYNOTE-355試験の結果に基づき、PD-L1陽性、ホルモン受容体陰性、ヒト上皮成長因子受容体 2陰性、手術不能または再発乳がんの患者に対する治療薬として、また第3相KEYNOTE-177試験の結果に基づき、切除不能の進行・再発MSI-Highの結腸・直腸がんの患者に対する治療薬として承認を取得。これらの承認により、KEYTRUDAは、日本で9種類のがんおよびMSI-High固形がんの適応症を含む15の承認を取得。
- 追加データの公開および更新情報:
- PD-L1を発現している(CPS ≧10)転移性TNBC患者においてKEYTRUDAと化学療法(パクリタキセル、ナブパクリタキセルまたはゲムシタビン/カルボプラチン)の併用療法による一次治療は、化学療法単独と比較して死亡リスクを27%低下させた第3相KEYNOTE-355試験の最終OSの結果を欧州臨床腫瘍学会(ESMO)で発表。
- 転移性去勢抵抗性前立腺がんの男性患者に対する一次治療において、相同組換え修復関連遺伝子変異の有無に関わらず、Lynparzaとアビラテロンおよびプレドニゾロンの併用療法では、アビラテロン+プレドニゾロンのみを投与した場合と比較して画像診断に基づく無増悪生存期間の改善を示した第3相PROpel試験の良好な結果を発表。
その他のハイライト
ワクチン
- 生後42〜90日の健康乳児を対象とするVAXNEUVANCE(15価肺炎球菌結合型ワクチン)の免疫原性、安全性、忍容性を評価する第3相PNEU-PED(V114-029)試験のトップラインデータを発表。
- 18歳以上の成人を対象とし、肺炎球菌に起因する侵襲性感染症および肺炎の予防のための能動免疫を目的にVAXNEUVANCEの承認をEMAのCHMPが推奨したことを発表。CHMPの推奨については、EUにおける販売承認について欧州委員会が審査中であり、本年度末には最終結論が出される予定。
- 当社は、米国疾病予防管理センター(CDC)の予防接種諮問委員会(ACIP)が、65歳以上および特定の基礎疾患またはその他のリスク因子を有する19歳から64歳までの成人に対して、VAXNEUVANCEに続きPNEUMOVAX 23(多価肺炎球菌ワクチン)、または20価肺炎球菌結合型ワクチンを投与する連続接種レジメンを暫定的に推奨したことを発表。最終推奨事項は、CDCおよび米国保健福祉省(Department of Health and Human Services)のディレクターによる審査を受け、CDCの発症・死亡率週間報告書(MMWR:Morbidity and Mortality Weekly Report)に正式に掲載される予定。
感染症
- 開発中の1日1回経口投与のドラビリン/イスラトラビル配合錠について、他の抗レトロウイルス治療レジメン(ILLUMINATE SWITCH A)、またはビクテグラビル/エムトリシタビン/テノホビルアラフェナミド(ILLUMINATE SWITCH B)によりウイルス学的抑制が得られている成人HIV-1感染症患者を対象とする2つの第3相試験の良好なトップラインデータを発表。
- ZERBAXA(タゾバクタムナトリウム/セフトロザン硫酸塩)注射剤は、2020年の製品自主回収を経て2021年度第4四半期に米国で段階的な再供給を開始する予定。小児の複雑性尿路感染症および複雑性腹腔内感染症の治療薬としてZERBAXA に関する2件の適応追加申請をFDAは受理。PDUFAによる日付は、それぞれ2022年4月21日と2022年5月2日に指定。
2021年度第3四半期の業績
以下の表は当社の医薬品の売上高上位製品およびアニマルヘルス製品の売上高総額を表しています。
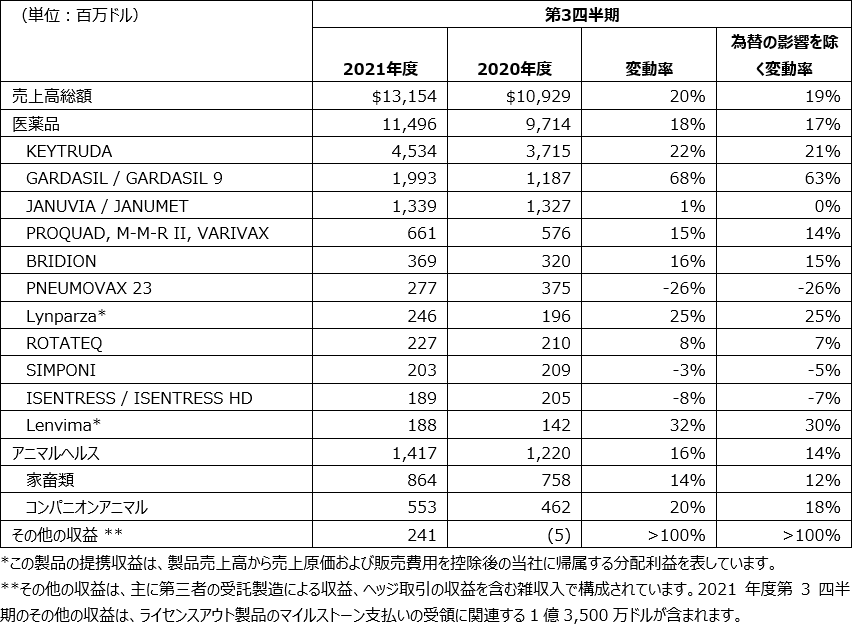
医薬品の業績
2021年度第3四半期の医薬品売上高は、前年同期比18%増の115億ドルとなりました(為替のプラス影響を除き17%増)。この増加は、堅調なオンコロジーおよびワクチン事業を反映しています。
オンコロジー領域の成長は、主にKEYTRUDAの売上高増加によるもので、KEYTRUDAの当第3四半期の売上高は前年同期比22%増の45億ドルとなっています。KEYTRUDAの世界的な売上高増加は、非小細胞肺がんの適応における力強い進展が続いていること、またRCC、頭頸部扁平上皮がん、TNBC およびMSI-High固形がんを含む適応症追加を反映しています。また、主に米国および欧州における継続的な適応症追加の承認を反映し25%の増加となったLynparzaの提携収益、さらに米国および中国における需要の増加を反映し32%増となったLenvimaの提携収益も、オンコロジー領域の売上高増加に貢献しました。
2021年度第3四半期のワクチン領域の成長は、HPVによるがん、およびその他のHPV関連疾患を予防するGARDASILおよびGARDASIL 9の合算売上高の増加が主にけん引しました。2021年度第3四半期のGARDASIL/GARDASIL 9の売上高は、68%増の20億ドルとなりました。これは、特に中国における供給量の増加、および米国における公的機関による購入時期がプラス影響となり、世界的に堅調な需要に主にけん引されました。
小児ワクチンであるVARIVAX(水痘ワクチン)、PROQUAD(麻しん-おたふくかぜ-風しん-水痘混合ワクチン)、およびM-M-R II(麻しん-おたふくかぜ-風しん混合ワクチン)の2021年度第3四半期の合算売上高は、米国における健康診断の継続的な回復を主に反映し、15%増の6億6,100万ドルとなりました。
ワクチンの業績は、肺炎球菌感染症を予防するワクチンであるPNEUMOVAX 23の売上高減少によるマイナス影響を受けました。COVID-19ワクチンの優先性により米国における需要が低下し、PNEUMOVAX 23の売上高は26%減の2億7,700万ドルとなりました。
急性期治療・病院領域の業績は、特定の細菌に感染した成人患者に対する治療薬であるセフェム系抗生物質とβ-ラクタマーゼ阻害薬の配合剤であるZERBAXA注射剤の2020年度第4四半期の製品回収に伴う一時的な販売停止を反映しています。このマイナス影響は、成人および2歳以上の小児患者を対象とした外科手術処置時の筋弛緩薬ロクロニウム臭化物またはベクロニウム臭化物の回復剤であるBRIDION注射液100 mg/mL(スガマデクスナトリウム)の世界的な需要の増加(COVID-19パンデミックからの継続的な回復が一部寄与し、16%増の3億6,900万ドル)、および成人および6カ月以上の小児患者を対象としたクロストリジウム・ ディフィシル関連下痢症の治療薬であるマクロライド抗菌薬のDIFICID(フィダキソマイシン)の米国における成長により一部相殺されました。
アニマルヘルスの業績
アニマルヘルスの2021年度第3四半期の全世界での売上高は、前年同期比で16%増の14億ドルでした(為替のプラス影響を除き、14%増)。アニマルヘルスの売上高増加は、生物薬剤のポートフォリオおよびアニマルヘルスインテリジェンスのポートフォリオを含む、世界全体で動物種全般の成長を反映しています。家畜類製品の売上高増加は、アニマルヘルスインテリジェンス関連製品を含む反芻動物関連製品の世界的に高い需要を主に反映しています。コンパニオンアニマル関連製品の売上高増加は、BRAVECTOなどの寄生虫予防薬およびワクチンが主にけん引しました。
2021年度第3四半期の費用、EPSおよび関連情報
以下の表は、費用に関する抜粋情報を表しています。
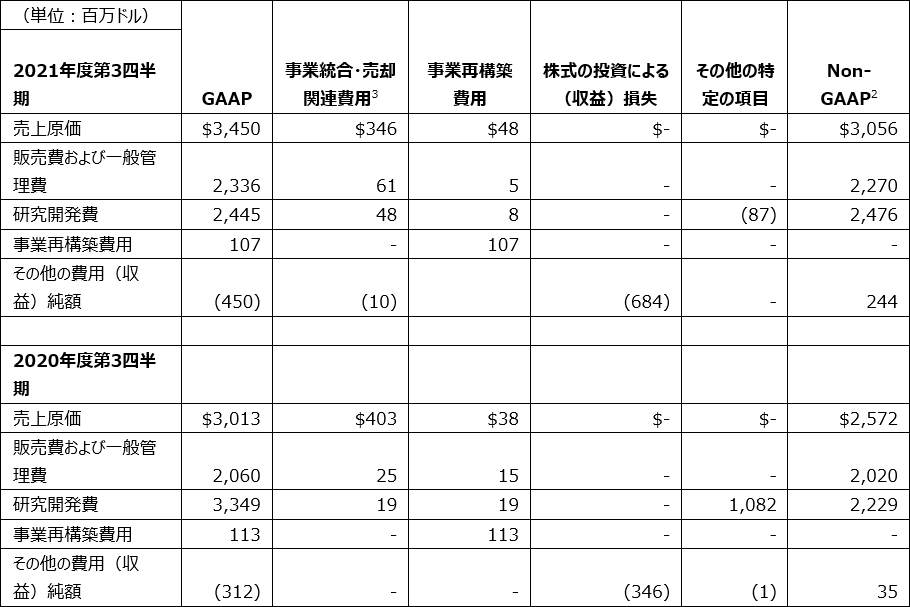
GAAPベースの費用、EPSおよび関連情報
GAAPベースでは、2021年度第3四半期の売上高総利益率は73.8%で、2020年度第3四半期では72.4%でした。2021年度第3四半期における売上高総利益率の増加は主に、プロダクト・ミックスのプラス影響、および事業統合・売却関連費用の減少によるものですが、製造コストの増加により一部相殺されました。
2021年度第3四半期の販売費および一般管理費は、前年同期比で13%増の23億ドルでした。この増加は主に、管理費の増加、当社の成長分野を支える販売促進費の増加、事業統合・売却関連費用の増加、および為替のマイナス影響を反映しています。
2021年度第3四半期の研究開発費は24億ドルで、2020年度第3四半期は33億ドルでした。この減少は主に、提携およびライセンス合意に関連した前払金の減少を反映していますが、オンコロジーおよびCOVID-19関連の臨床開発費の増加、および開発候補品の発見と初期の医薬品開発への投資の増加により一部相殺されました。
2021年度第3四半期のその他の費用(収益)純額は、2020度第3四半期の3億1,200万ドルの収益に対し4億5,000万ドルの収益を計上しました。これは、株式の投資による収益の増加を主に反映していますが、会計上の年金清算処理によるものの増加により一部相殺されました。
2021年度第3四半期の実効税率は13.2%となりました。2021年度第3四半期の実効税率は、外国税問題の解決に関連したプラス影響を反映しています。
2021年度第3四半期のGAAPベースのEPSは1.80ドル、2020年度第3四半期では0.92ドルでした。
non-GAAPベースの費用、EPSおよび関連情報
non-GAAPベースでは、2021年度第3四半期の売上高総利益率は76.8%で、2020年度第3四半期では76.5%でした。2021年度第3四半期のnon-GAAPベースの売上高総利益率の増加は主に、プロダクト・ミックスのプラス影響によるものですが、製造コストの増加により一部相殺されました。
2021年度第3四半期のnon-GAAPベースの販売費および一般管理費は、前年同期比で12%増の23億ドルでした。この増加は主に、管理費の増加、当社の成長分野を支える販売促進費の増加、および為替のマイナス影響を反映しています。
2021年度第3四半期のnon-GAAPベースの研究開発費は25億ドルで、2020年度第3四半期の11%増となりました。この増加は主に、オンコロジーおよびCOVID-19関連の臨床開発費の増加、および開発候補品の発見と初期の医薬品開発への投資の増加を反映しています。
non-GAAPベースでの2021年度第3四半期のその他の費用(収益)純額は、2020年度第3四半期の3,500万ドルの費用に対し2億4,400万ドルの費用を計上しました。これは、年金清算処理によるものの増加を主に反映しています。
2021年度第3四半期のnon-GAAPベースの実効税率は13.0%となりました。これは、外国税問題の解決に関連したプラス影響を反映しています。
2021年度第3四半期のnon-GAAPベースのEPSは1.75ドル、2020年度第3四半期では1.37ドルでした。
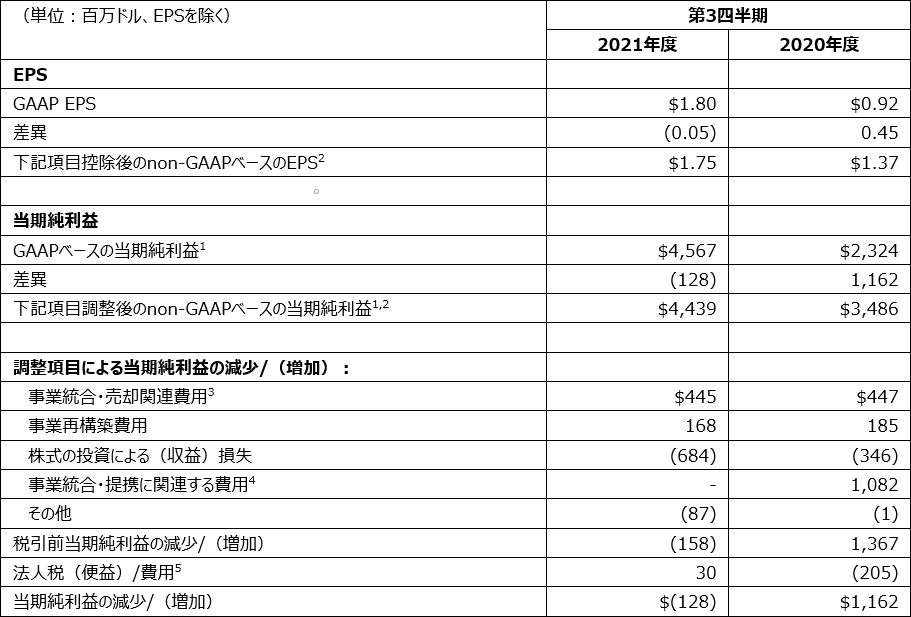
当期純利益およびEPSのGAAPベースからnon-GAAPベースへの調整は、以下の表のとおりです。
業績見通し
当社の事業全体において世界規模で根本的な需要が堅調に続いています。当社は、通期の予想収益とEPSを上方修正しています。2021年10月中旬の為替を基準として、為替のプラス影響約1.5%を含み、2021年度の売上高成長を14%~15%、2021年度通期の収益を474億ドル~479億ドルになると予想しています。
当社は引き続き、患者さんを含めグローバルな医療システム全体でCOVID-19パンデミックの影響に対し適応が大きく進んできたと考えており、今後も一定のマイナス影響が残る一方で、回復傾向は継続すると予想しています。当社の2021年度の収益に対して3%未満のCOVID-19パンデミックのマイナス影響が、関連するすべての医薬品セグメントの業績に及ぶと予想しています。
当社は、2021年度通期のGAAPベースのEPSレンジを4.71ドル~4.76ドルに上方修正しています。
当社は、為替のプラス影響約2%を含み、2021年度通期のnon-GAAPベースのEPSレンジを5.65ドル~5.70ドルに上方修正しています。このnon-GAAPベースEPSレンジは、事業統合・売却関連費用、事業再構築計画関連費用、株式の投資による収益と損失、および特定のその他の項目を除外しています。売上予測またはEPSガイダンスのレンジ予測は、当社のCOVID-19に関する抗ウイルス候補薬モルヌピラビルが上市する可能性を加味していません。
以下の表は、当社の2021年の業績ガイダンスの要約を表しています。
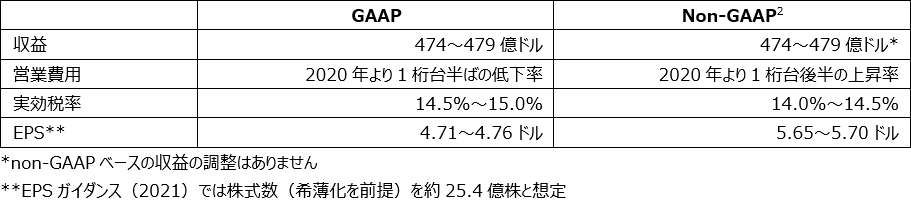
2021年度のGAAPベースの予想EPSからnon-GAAPベースのEPSへの調整、およびnon-GAAPベースのEPSからの控除項目は以下の表のとおりです。

Merck & Co., Inc., Kenilworth, N.J., U.S.A.について
Merck & Co., Inc., Kenilworth, N.J., U.S.A.(米国とカナダ以外ではMSD)は130年にわたり、人々の生命を救い、人生を健やかにするというミッションのもと、世界で最も治療が困難な病気のために、革新的な医薬品やワクチンの発見、開発、提供に挑みつづけてきました。また、多岐にわたる政策やプログラム、パートナーシップを通じて、患者さんの医療へのアクセスを推進する活動に積極的に取り組んでいます。私たちは、今日、がん、HIVやエボラといった感染症、そして新たな動物の疾病など、人類や動物を脅かしている病気の予防や治療のために、研究開発の最前線に立ち続け、世界最高の研究開発型バイオ医薬品企業を目指しています。詳細については、当社ウェブサイトやTwitter、Facebook、Instagram、YouTube、LinkedInをご参照ください。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.の将来に関する記述
Merck & Co., Inc., Kenilworth, N.J., U.S.A.(以下、当社)発行のこのニュースリリースには、米国の1995年私的証券訴訟改革法(the Private Securities Litigation Reform Act of 1995)の免責条項で定義された「将来に関する記述」が含まれています。これらの記述は、当社の経営陣の現時点での信条と期待に基づくもので、相当のリスクと不確実性が含まれています。Acceleron社パイプラインを含む(Acceleron社の買収が完了した場合)、新薬パイプラインに対する承認取得またはその製品化による収益を保証するものではありません。予測が正確性に欠けていた場合またはリスクもしくは不確実性が現実化した場合、実際の成果が、将来に関する記述で述べたものと異なる場合も生じます。
リスクと不確実性には、業界の一般的な状況および競争環境、買付提案のタイミングおよび後のAcceleron社との合併に関する不確実性、Acceleron社の株主が買付提案に応じる人数の不確実性、対抗提案または買収提案が出されるリスク、合併に関する各種の条件および提案が達成されない可能性または撤回する可能性、合併合意により予定取引が停止した場合の影響および合併合意の公表による影響、Acceleron社の事業における未決取引の影響、買収提案または合併に伴う株主訴訟が弁護、賠償、法的責任に関連する相当費用を発生させるリスク、金利および為替レートの変動などの一般的な経済要因、新型コロナウイルス感染症(COVID-19)の世界的大流行の影響、医薬品業界の規制やヘルスケア関連の米国法および国際法が及ぼす影響、ヘルスケア費用抑制の世界的な傾向、競合他社による技術的進歩や新製品開発および特許取得、承認申請などの新薬開発特有の問題、当社による将来の市況予測の正確性、製造上の問題または遅延、国際経済および政府の信用リスクなどの金融不安、画期的製品に対する当社の特許権やその他の保護の有効性への依存、特許訴訟や規制措置の対象となる可能性等がありますが、これらに限定されるものではありません。
当社は、新たな情報、新たな出来事、その他いかなる状況が加わった場合でも、将来に関する記述の更新を行う義務は負いません。将来に関する記述の記載と大きく異なる成果を招くおそれがあるこの他の要因については、当社に関するForm 10-Kの2020年度年次報告書およびSECのインターネットサイト(www.sec.gov)で入手できる米国証券取引委員会(SEC)に対するこの他の書類で確認できます。
1 Merck & Co., Inc., Kenilworth, N.J., U.S.A.に帰属する当期純利益(継続的事業活動に基づく)
2 Merck & Co., Inc., Kenilworth, N.J., U.S.A.は、事業業績や傾向に関する分析への特定項目の性質による影響を考慮し、2021年度および2020年度の特定の項目の影響を除いたnon-GAAPベースの情報を提供しています。経営陣は、この情報が会社の決算結果および経営陣による業績評価方法に関する投資家の理解を深めるものと考えています。経営陣は、これらの指標を目標の設定や達成予測のため、またその他の基準で当社の業績を評価するために社内的に活用します。加えて、上級管理職の年間報酬の一部はnon-GAAPベースの税引前利益から支払われています。これはGAAPに基づき算出された情報に関する追加情報であって、その代わりとなるものではなく、また優先されるものでもありません。
3 事業統合・売却に関する統合費用、取引費用およびその他の費用と共に、無形資産の償却費および棚卸資産に対するパーチェス法適用に伴う調整額、無形資産の減損損失、および、条件付対価による負債の公正価値測定の見積り変更に関連する費用または収益が含まれます。
4 2020年度はSeagen社との提携に関連する費用8億3,200万ドルが含まれます。
5 調整項目に対する見積法人税の影響が含まれます。さらに2020年度の金額には、税額6,700万ドル(2015年のCubist Pharmaceuticals, Inc.の買収と関連して計上した法人税額減少の調整)が含まれます。
6 調整項目に対する見積法人税の影響、および特定の連邦所得税問題の解決に関連した2億700万ドルの法人税額の減少が含まれます。
# # #
MSDについて
MSD(Merck & Co., Inc., Kenilworth, N.J., U.S.A.が米国とカナダ以外の国と地域で事業を行う際に使用している名称)は、130年にわたり、人々の生命を救い、人生を健やかにするというミッションのもと、世界で最も治療が困難な病気のために、革新的な医薬品やワクチンの発見、開発、提供に挑みつづけてきました。MSDはまた、多岐にわたる政策やプログラム、パートナーシップを通じて、患者さんの医療へのアクセスを推進する活動に積極的に取り組んでいます。私たちは、今日、がん、HIVやエボラといった感染症、そして新たな動物の疾病など、人類や動物を脅かしている病気の予防や治療のために、研究開発の最前線に立ち続けています。MSDは世界最高の研究開発型バイオ医薬品企業を目指しています。MSDの詳細については、弊社ウェブサイト(www.msd.co.jp)やFacebook、Twitter、YouTubeをご参照ください。