LYNPARZA® (olaparib)、第3相PROfound試験においてエンザルタミドまたはアビラテロンの投与により病勢進行が認められたBRCA1/2またはATM遺伝子変異陽性の転移性去勢抵抗性前立腺がん患者に対し、エンザルタミドまたはアビラテロンと比較して死亡リスクを31%低減 LYNPARZA®は転移性去勢抵抗性前立腺がん患者において全生存期間を延長した唯一のPARP阻害剤
2020/09/30 00:00 Asia/Tokyo
報道関係各位
MSD株式会社
この参考資料は、LYNPARZA Reduced Risk of Death by 31% vs. Enzalutamide or Abiraterone for Men with BRCA1/2 or ATM-Mutated Metastatic Castration Resistant Prostate Cancer Who Progressed Following Enzalutamide or Abiraterone in Phase 3 PROfound Trial の日本語訳であり、内容や解釈については英語が優先されます。適応症と安全性情報も米国のものであり、日本国内の情報ではありません。
LYNPARZA®は、日本ではリムパーザ®として、白金系抗悪性腫瘍剤感受性の再発卵巣癌における維持療法、BRCA遺伝子変異陽性の卵巣癌における初回化学療法後の維持療法、がん化学療法歴のあるBRCA遺伝子変異陽性かつHER2陰性の手術不能又は再発乳癌に対する効能又は効果で承認を取得しております。
参考資料
LYNPARZA® (olaparib)、第3相PROfound試験においてエンザルタミドまたはアビラテロンの投与により病勢進行が認められた
BRCA1/2またはATM遺伝子変異陽性の転移性去勢抵抗性前立腺がん患者に対し、
エンザルタミドまたはアビラテロンと比較して死亡リスクを31%低減
LYNPARZA®は転移性去勢抵抗性前立腺がん患者において
全生存期間を延長した唯一のPARP阻害剤
2020年9月20日ニュージャージー州ケニルワース―アストラゼネカとMerck & Co., Inc., Kenilworth, N.J., U.S.A.(米国とカナダ以外ではMSD)は本日、LYNPARZA®が第3相PROfound試験の最終結果において、BRCA1/2またはATM遺伝子変異陽性の転移性去勢抵抗性前立腺がん(mCRPC)患者を対象とし、エンザルタミドまたはアビラテロンと比較して、全生存期間(OS)の統計学的に有意かつ臨床的に意義のある延長を示したことを発表しました。本試験には、エンザルタミドまたはアビラテロンの投与により病勢進行が認められた患者が参加しています。
前立腺がんは男性において2番目に罹患率が高いがんであり、2018年には世界中で推定130万人が新たに前立腺がんと診断されました。mCRPC患者の約20~30%に相同組換え修復関連(HRR)遺伝子の変異がみられ、BRCA1/2遺伝子またはATM遺伝子変異陽性も含まれます。初期ホルモン感受性前立腺がん症例の約10〜20%は、約5年以内にCRPCに進行します。
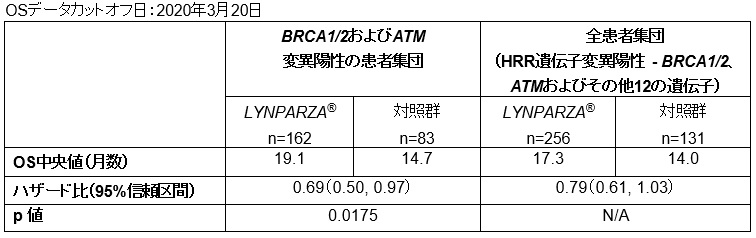
副次評価項目であるBRCA1/2遺伝子またはATM遺伝子変異陽性患者のOSについて、LYNPARZA®は、エンザルタミドまたはアビラテロンと比較して死亡リスクを31%低減しました(HR=0.69 [95% CI, 0.50-0.97]; p=0.0175)。エンザルタミドまたはアビラテロン投与群患者の66%が、病勢進行後にLYNPARZA®をクロスオーバーして投与されていたにもかかわらず、OSの中央値はエンザルタミドまたはアビラテロン投与群では14.7カ月であったのに対し、LYNPARZA®投与群では19.1カ月でした。
HRR遺伝子(BRCA1/2、ATM、CDK12およびその他11のHRR遺伝子)変異を有する全患者を含めた集団を対象に行った探索的解析でも、エンザルタミドまたはアビラテロン投与群と比較して、LYNPARZA®投与群で死亡リスクが21%低減し、OSの延長傾向を示しました(HR=0.79 [95% CI, 0.61-1.03])。OSの中央値は、エンザルタミドまたはアビラテロン投与群では14.0カ月であったのに対し、LYNPARZA®投与群では17.3カ月でした。
発現率15%以上の主な有害事象は貧血(50%)、悪心(43%)、疲労・無力症(42%)、食欲減退(31%)、下痢(21%)、嘔吐(20%)および便秘(19%)でした。また、主なグレード3以上の有害事象は貧血(23%)、悪心(2%)、疲労・無力症(3%)、食欲減退(2%)および下痢(1%)でした。LYNPARZA®投与群では有害事象により20%の患者が投与を中止し、23%の患者が減量しました。
PROfound試験の治験責任医師の一人で、The Institute for Cancer Researchの医薬品開発部門および王立マースデン病院の責任者であるJohann de Bono博士は、「PROfound試験においてLYNPARZA®は複数の重要な評価項目で統計学的に有意で臨床的に意義のある有効性を示しており、BRCA1/2遺伝子またはATM遺伝子変異陽性患者さんのOSの最終結果から、mCRPC患者さんの標準治療が変わる可能性がより強固なものとなりました。PROfound試験の結果によって、LYNPARZA®が今後、これまで予後が不良で治療選択肢がほとんどなかった患者さん方に、プレシジョン・メディシン時代の新たな分子標的薬として、前立腺がんの治療において重要な役割を担う可能性があることを示しています」と述べています。
アストラゼネカのオンコロジー研究開発担当エグゼクティブバイスプレジデントであるJosé Baselga博士は、「今回得られた最終結果により、これまで生存期間延長を達成するのが非常に困難だった特定のmCRPC患者さんの治療状況を変える可能性があります。LYNPARZA®は、BRCAまたはATM遺伝子変異陽性の患者さんにおいてエンザルタミドまたはアビラテロンと比較して、生存期間の延長を示した唯一のPARP阻害剤です。引き続き、世界中の患者さんにLYNPARZA®をお届けしていきたいと願っています」と述べています。
当社研究開発本部シニアバイスプレジデント、グローバル臨床開発責任者でチーフメディカルオフィサーのRoy Baynes博士は、「PROfound試験は、特定のmCRPC患者さんにおける治療選択肢を同定するために、分子バイオマーカー検査を用いて良好な結果が得られた最初の第3相試験です。これらの結果は、高リスクの患者さんを特定するとともに、医師が治療選択を判断するための、HRR遺伝子変異に対する遺伝子検査の重要性を裏付けるものです。これらの結果は、特定のHRR遺伝子変異を有するmCRPC患者さんにおけるLYNPARZA®の潜在的価値を示しています」と述べています。
PROfound試験のOSの最終結果は、2020年欧州臨床腫瘍学会(ESMO)バーチャル会議において、9月20日(日)の会長シンポジウムで発表され、同時にThe New England Journal of Medicineにも掲載されました。
OS結果の概要
第3相PROfound試験では、BRCA1/2遺伝子またはATM遺伝子変異陽性の患者集団において、画像診断に基づく無増悪生存期間(rPFS)の有意な延長を示し、2019年8月に主要評価項目を達成しました。また、本試験では副次評価項目である全HRR遺伝子変異を有する患者集団におけるrPFSの統計学的に有意かつ臨床的に意義のある延長も達成しており、これは2020年5月の米国による承認の根拠となっています。EUやその他の国においても規制当局による審査が進行中です。
アストラゼネカとMerck & Co., Inc., Kenilworth, N.J., U.S.A.は、転移性前立腺がんに関する臨床試験を他にも実施しており、その中には、mCRPCの一次治療として、LYNPARZA®とアビラテロンとの併用療法をアビラテロン単剤療法と比較・評価する第3相PROpel試験が含まれます。同試験のデータは、2021年に解析を予定しています。
PROfound試験について
PROfound試験は前向きな無作為化非盲検多施設共同第3相試験で、アビラテロンまたはエンザルタミドとの比較において、LYNPARZA®の有効性と安全性を評価する試験です。本試験は、アビラテロンまたはエンザルタミによる治療歴のある進行がんで、かつHRR遺伝子(BRCA1/2、ATM、CDK12, BARD1, BRIP2, CHEK1, CHEK2, PALB2, PPP2R2A, RAD51B, RAD51D, RAD54L)のいずれかに変異が見られるmCRPC患者を対象に実施しました。
この試験は、HRR遺伝子変異陽性を有する患者を2つのコホートに振り分けて組み入れ、解析するよう設計されました。主要評価項目はBRCA1/2またはATM遺伝子変異を有する患者のrPFSであり、LYNPARZA®が臨床的効果を示した場合、副次的な解析対象集団として、HRR遺伝子変異(BRCA1/2、ATM、CDK12およびその他11のHRR遺伝子)を有する全患者を含めた集団も対象に解析を実施しました。
LYNPARZA®用法・用量・安全性情報について
用法・用量・安全性情報など一部情報は米国のもので、日本の情報ではありません。詳しくは当社英文リリースをご参照ください。
LYNPARZA® (olaparib)について
LYNPARZA®はファーストインクラスのPARP阻害剤であり、BRCA遺伝子変異などDNA損傷応答(DDR)経路の異常に作用することで、がん細胞を選択的に死滅させる初の標的治療薬です。LYNPARZA®によるPARP阻害は、DNA一本鎖切断に結合するPARPを捕捉し、複製フォーク停止と崩壊を惹起することで、DNA二本鎖切断を起こしがん細胞を死滅させます。LYNPARZA®はDDR経路に異常をきたした一連のPARP依存性の腫瘍タイプにおいて試験が進行中です。
アストラゼネカとMSDが共同で開発と商業化を行っているLYNPARZA®は、広範かつ最先端の臨床試験開発プログラムを有しており、アストラゼネカとMSDは、さまざまながん種にわたり、LYNPARZAが単剤療法および他の薬剤との併用療法として様々なPARP依存性腫瘍に及ぼす影響を解明するために協業しています。
転移性去勢抵抗性前立腺がん(mCRPC)について
前立腺がんは男性において2番目に罹患率が高いがんです。2018年には世界中で推定130万人が新たに前立腺がんと診断され、高い死亡率を伴っています。前立腺がんの発症は多くの場合、テストステロンを含むアンドロゲンと呼ばれる男性ホルモンにより促進されます。男性ホルモンの作用を阻害するアンドロゲン除去療法を行ったにもかかわらず、前立腺がんが増殖し、他の部位に転移した場合、mCRPCと診断されます。進行前立腺がん患者の約10~20%は5年以内に去勢抵抗性前立腺がん(CRPC)へと進行し、そのうち84%以上の患者はCRPC診断時に転移を有しています。また、CRPC診断時に転移のない患者であっても、そのうちの33%は2年以内に転移が確認されます。mCRPCに対する治療選択肢は増えてきていますが、依然として5年生存率は低く、これらの患者の治療において生存期間を延長させることが、引き続き主要な治療目標となっています。
相同組換え修復関連(HRR)遺伝子変異について
mCRPC患者の約20~30%に相同組換え修復関連(HRR)遺伝子変異が発現しています。正常細胞において、HRR遺伝子はDNAの損傷の正確な修復に関与しています。HRRが欠損(HRD)するとDNAの損傷が修復されず、正常細胞の死をもたらします。しかし、がん細胞においてはこれとは異なり、HRR経路の変異が異常な細胞を増殖させ、がんを引き起こします。HRDは、LYNPARZA®などのPARP阻害剤の標的となるがん細胞の特徴として立証されています。PARP阻害剤はDNA一本鎖切断に結合するPARPを捕捉し、複製フォークの停止と崩壊を惹起することで、DNA二本鎖切断を引き起こしがん細胞死を誘導します。
アストラゼネカとMerck & Co., Inc., Kenilworth, N.J., U.S.A.のがん領域における戦略的提携について
2017年7月、アストラゼネカ社とMerck & Co., Inc., Kenilworth, N.J., U.S.A(北米およびカナダ以外ではMSD)は、世界初のPARP阻害剤であるLYNPARZA®を含む特定のがん治療薬について、複数のがん種において共同開発・商業化するがん領域における世界的な戦略的提携を発表しました。両社は、これらの薬剤を他の可能性のある新薬との併用療法および単剤療法として共同開発します。なお、これらのがん治療薬と、各々の会社が保有するPD-L1またはPD-1阻害薬との併用療法は各々の会社で開発します。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.のがん領域における取り組み
Merck & Co., Inc., Kenilworth, N.J., U.S.A.では、画期的な科学を革新的ながん治療薬に変換して世界中のがん患者さんを助けることに取り組んでいます。オンコロジー事業にとって、がんと闘う人々を助けることは私たちの情熱であり、がん治療薬へアクセスしやすくすることは私たちの責任です。また、がん領域における取り組みの一環として、医薬品業界で一二を争う急成長を遂げている開発プログラムにより、30種類以上のがんに対するがん免疫療法の可能性を模索しています。また、引き続き戦略的買収を通じて、がん免疫療法のポートフォリオを強化し、進行がんの治療を改善する可能性をもつ有望ながん治療薬候補の開発を最優先に進めています。当社のオンコロジー臨床試験について詳しくは、当社ウェブサイトをご覧ください。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.について
Merck & Co., Inc., Kenilworth, N.J., U.S.A. (米国とカナダ以外ではMSD)は、125年以上にわたり、人々の生命を救い、人生を健やかにするというミッションのもと、世界で最も治療が困難な病気のために、革新的な医薬品やワクチンの発見、開発、提供に挑みつづけてきました。MSDはまた、多岐にわたる政策やプログラム、パートナーシップを通じて、患者さんの医療へのアクセスを推進する活動に積極的に取り組んでいます。私たちは、今日、がん、HIVやエボラといった感染症、そして新たな動物の疾病など、人類や動物を脅かしている病気の予防や治療のために、研究開発の最前線に立ち続けています。MSDは世界最高の研究開発型バイオ医薬品企業を目指しています。詳細については当社ウェブサイトやMerck & Co., Inc., Kenilworth, N.J., U.S.A.の ![]() Twitter 、
Twitter 、 ![]() Facebook 、
Facebook 、 ![]() Instagram 、
Instagram 、![]() YouTube および、
YouTube および、![]() Linkedln をご参照ください。
Linkedln をご参照ください。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.の将来に関する記述
Merck & Co., Inc., Kenilworth, N.J., U.S.A.(以下、当社)発行のこのニュースリリースには、米国の1995年私的証券訴訟改革法(the Private Securities Litigation Reform Act of 1995)の免責条項で定義された「将来に関する記述」が含まれています。これらの記述は、当社の経営陣の現時点での信条と期待に基づくもので、相当のリスクと不確実性が含まれています。新薬パイプラインに対する承認取得またはその製品化による収益を保証するものではありません。予測が正確性に欠けていた場合またはリスクもしくは不確実性が現実化した場合、実際の成果が、将来に関する記述で述べたものと異なる場合も生じます。
リスクと不確実性には、業界の一般的な状況および競争環境、金利および為替レートの変動などの一般的な経済要因、昨今の新型コロナウイルス感染症(COVID-19)の世界的大流行の影響、医薬品業界の規制やヘルスケア関連の米国法および国際法が及ぼす影響、ヘルスケア費用抑制の世界的な傾向、競合他社による技術的進歩や新製品開発および特許取得、承認申請などの新薬開発特有の問題、当社による将来の市況予測の正確性、製造上の問題または遅延、国際経済および政府の信用リスクなどの金融不安、画期的製品に対する当社の特許権やその他の保護の有効性への依存、特許訴訟や規制措置の対象となる可能性等がありますが、これらに限定されるものではありません。
当社は、新たな情報、新たな出来事、その他いかなる状況が加わった場合でも、将来に関する記述の更新を行う義務は負いません。将来に関する記述の記載と大きく異なる成果を招くおそれがあるこの他の要因については、当社に関するForm 10-Kの2019年度年次報告書およびSECのインターネットサイト(![]() www.sec.gov)で入手できる米国証券取引委員会(SEC)に対するこの他の書類で確認できます。
www.sec.gov)で入手できる米国証券取引委員会(SEC)に対するこの他の書類で確認できます。
# # #
MSDについて
MSD(Merck & Co., Inc., Kenilworth, N.J., U.S.A.が米国とカナダ以外の国と地域で事業を行う際に使用している名称)は、125年以上にわたり、人々の生命を救い、人生を健やかにするというミッションのもと、世界で最も治療が困難な病気のために、革新的な医薬品やワクチンの発見、開発、提供に挑みつづけてきました。MSDはまた、多岐にわたる政策やプログラム、パートナーシップを通じて、患者さんの医療へのアクセスを推進する活動に積極的に取り組んでいます。私たちは、今日、がん、HIVやエボラといった感染症、そして新たな動物の疾病など、人類や動物を脅かしている病気の予防や治療のために、研究開発の最前線に立ち続けています。MSDは世界最高の研究開発型バイオ医薬品企業を目指しています。MSDの詳細については、弊社ウェブサイト(![]() www.msd.co.jp)や
www.msd.co.jp)や ![]() Facebook 、
Facebook 、![]() Twitter 、
Twitter 、 ![]() YouTube をご参照ください。
YouTube をご参照ください。