KEYTRUDA®(ペムブロリズマブ)とLENVIMA®(レンバチニブ)の併用療法による成人の進行性腎細胞がん一次治療に関する承認を米国FDAより取得 本承認により、本併用療法として進行性腎細胞がんを含む2種類のがんに適応が拡大 臨床第Ⅲ相CLEAR試験 / KEYNOTE-581試験において、対照薬のスニチニブと比較して、本併用療法は無増悪生存期間または死亡のリスクを61%有意に減少
2021/08/20 00:00 JST
報道関係各位
MSD株式会社
この参考資料は、FDA Approves KEYTRUDA® (pembrolizumab) Plus LENVIMA® (lenvatinib) Combination for First-Line Treatment of Adult Patients With Advanced Renal Cell Carcinoma (RCC) の日本語訳であり、内容や解釈については英語が優先されます。適応症と安全性情報も米国のものであり、日本国内の情報ではありません。
KEYTRUDA®は、日本ではキイトルーダ®として、悪性黒色腫、切除不能な進行・再発の非小細胞肺癌、再発又は難治性の古典的ホジキンリンパ腫、がん化学療法後に増悪した根治切除不能な尿路上皮癌、がん化学療法後に増悪した進行・再発の高頻度マイクロサテライト不安定性(MSI-High)を有する固形癌(標準的な治療が困難な場合に限る)注)、根治切除不能又は転移性の腎細胞癌、再発又は遠隔転移を有する頭頸部癌、がん化学療法後に増悪したPD-L1陽性の根治切除不能な進行・再発の食道扁平上皮癌に対する効能又は効果で承認を取得しております。LENVIMA®は、日本ではレンビマ®として、根治切除不能な甲状腺癌、切除不能な肝細胞癌、切除不能な胸腺癌に対する効能又は効果で承認を取得しております。 注) 条件付き早期承認対象
参考資料
KEYTRUDA®(ペムブロリズマブ)とLENVIMA®(レンバチニブ)の併用療法による
成人の進行性腎細胞がん一次治療に関する承認を米国FDAより取得
本承認により、本併用療法として進行性腎細胞がんを含む2種類のがんに適応が拡大
臨床第Ⅲ相CLEAR試験 / KEYNOTE-581試験において、対照薬のスニチニブと比較して、
本併用療法は無増悪生存期間または死亡のリスクを61%有意に減少
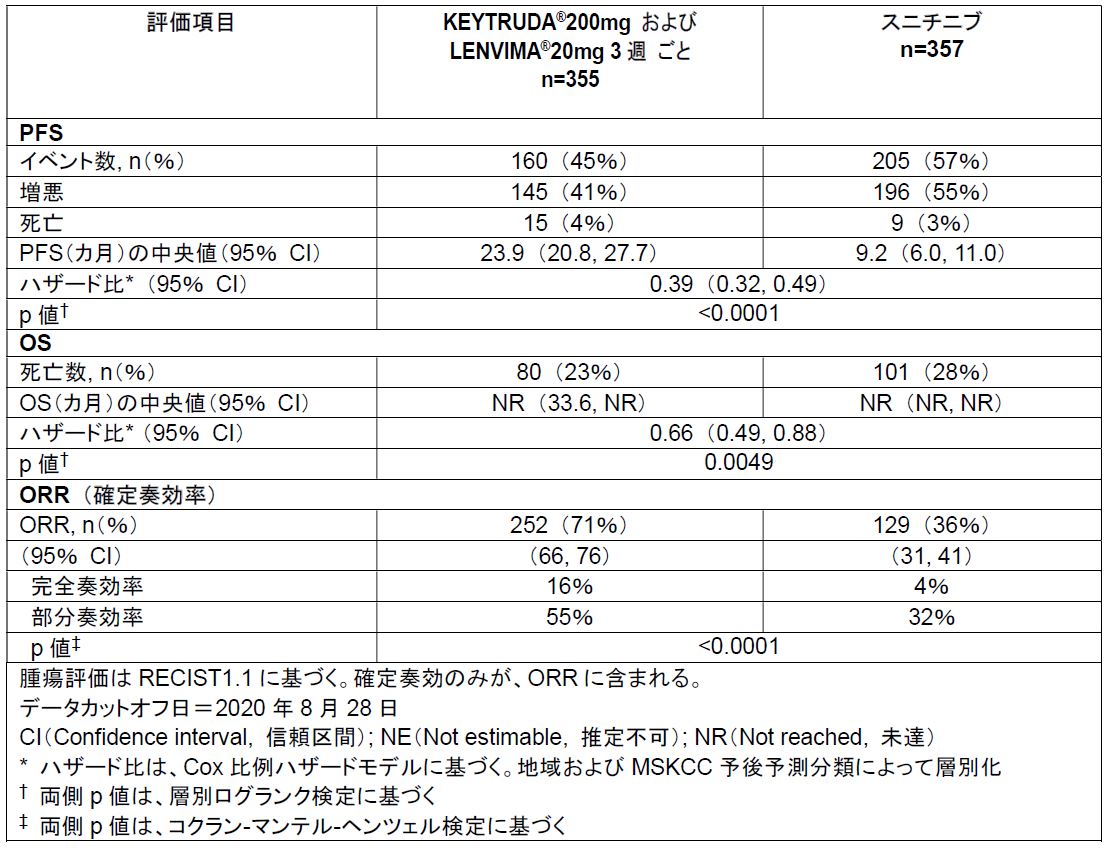
2021年8月11日 ニュージャージー州ケニルワース、ニュージャージー州ウッドクリフレイク―Merck & Co., Inc., Kenilworth, N.J., U.S.A.(米国とカナダ以外ではMSD)とエーザイ株式会社は本日、Merck & Co., Inc., Kenilworth, N.J., U.S.A.の抗PD-1抗体KEYTRUDA®とエーザイ創製の経口チロシンキナーゼ阻害剤LENVIMA®の併用療法による成人の進行性腎細胞がん一次治療としての適応について、米国食品医薬局(FDA)より承認を取得したことをお知らせします。本承認は、臨床第Ⅲ相CLEAR(307)試験/KEYNOTE-581 試験において、KEYTRUDA®とLENVIMA®の併用療法が、有効性アウトカムの指標である無増悪生存期間(Progression-Free Survival: PFS)、全生存期間(Overall Survival: OS)、および確定奏効率(Objective Response Rate: ORR)について、対照薬のスニチニブと比較して統計学的に有意な改善を示した結果に基づいています。
本併用療法のPFSは中央値が23.9カ月であり、スニチニブの9.2カ月と比較して、増悪または死亡のリスクを61%減少させました (HR=0.39 [95%信頼区間(Confidence Interval: CI): 0.32–0.49]; p<0.0001)。また、本併用療法は、OS について、スニチニブと比較して、死亡のリスクを34%減少させました(HR=0.66 [95%CI: 0.49–0.88]; p=0.0049)。加えて、本併用療法の確定ORR は71%(95%CI: 66-76)(n=252)であり、スニチニブは36% (95%CI: 31-41)(n=129)でした。本併用療法の完全奏効(Complete Response: CR)率は16%、部分奏効 (Partial Response: PR)率は55%であり、スニチニブのCR率は4%、PR率は32%でした。
免疫介在性有害事象は、あらゆる器官または組織において発現する可能性があり、同時に複数の体組織に影響を及ぼす可能性があり、重症または致死的なものが発現する可能性もあります。KEYTRUDA®投与中または投与後に発現する可能性のある免疫介在性有害事象には、肺臓炎、大腸炎、肝炎、内分泌障害、腎炎、皮膚反応、実質臓器移植拒絶反応、および同種造血幹細胞移植合併症が含まれます。KEYTRUDA®の安全な使用を担保する上で、免疫介在性有害事象の早期の同定およびマネジメントは必要不可欠です。有害事象の重症度に基づき、必要に応じて、KEYTRUDA®は休薬または投与中止し、コルチコステロイドの投与が必要となります。KEYTRUDA®は重篤または生命を脅かすinfusion reactionを引き起こす可能性があります。作用メカニズムに基づき、KEYTRUDA®は、妊婦に投与されると胎児に悪影響を及ぼす可能性があります。
LENVIMA®投与により発現する可能性のある有害事象(Adverse reactions)には、高血圧、心機能障害、動脈血栓塞栓症、肝毒性、腎不全または腎機能障害、蛋白尿、下痢、瘻孔形成ならびに消化管穿孔、QT間隔延長、低カルシウム血症、可逆性後白質脳症症候群、出血性イベント、甲状腺刺激ホルモン抑制障害/甲状腺機能障害、創傷治癒障害、顎骨壊死、および胚-胎児毒性が含まれ、重篤または致死的なものが発現する可能性があります。作用メカニズムおよび動物での再現試験に基づき、LENVIMA®は、妊婦に投与されると致死的な出血を引き起こす可能性があります。妊娠の可能性のある女性は避妊が推奨されます。有害事象の重症度により、LENVIMA®投与を休止、減量および/または、中止する必要があります。
Memorial Sloan Kettering Cancer Center, Genitourinary Oncology Service のKidney Cancer Section Head ならびにJack and Dorothy Byrne Chair in Clinical Oncology であるRobert Motzer博士は、「このたびの承認は、KEYTRUDA®とLENVIMA®の併用療法が、スニチニブと比較して、増悪または死亡のリスクを有意に減少させた臨床試験結果等に基づいています。本承認は新たに進行性腎細胞がんと診断された患者さんにとって重要なマイルストンであり、一次治療における有望な併用治療オプションを提供することができます」と述べています。
Merck & Co, Inc., Kenilworth, N.J., U.S.A. 研究開発本部 オンコロジークリニカルリサーチのバイスプレジデントであるGregory Lubiniecki博士は、「FDAによる本承認は、KEYTRUDA®とLENVIMA®の併用療法の可能性を高めるものであり、2種類目のがんの適応に対する承認です。臨床試験において、本併用療法は、進行性腎細胞がん患者さんに対するサバイバルベネフィットを示し、これらの患者さんに対する新たな一次治療オプションとしての重要性が支持されました。当社は、がん患者さんに延命効果をもたらす革新的な治療を創出することに注力してきました。我々は、エーザイとの協業の結果、進行性腎細胞がんの患者さんの生存期間の改善を達成し、さらに治療が困難な他のがん種の患者さんにおける本併用療法の可能性の追求にコミットしていることを誇りに思います」と述べています。
エーザイ株式会社の執行役 オンコロジービジネスグループ チーフメディスンクリエーションオフィサー兼チーフディスカバリーオフィサーである大和隆志博士は、「このたびのFDA による承認は、進行性腎細胞がんコミュニティーにとって、非常に重要なことです。進行性腎細胞がんを対象とした臨床第Ⅲ相 CLEAR 試験/KEYNOTE-581試験においてLENVIMA®とKEYTRUDA®の併用療法は、スニチニブと比較して、PFS、OSおよびORRの全てにおいてより高い有効性を示しました。これらの試験結果は、がん患者様の治療を改善したいとの想いから、進行性がんの患者様の新たな治療オプションを開発してきた我々の努力の成果であり、Merck & Co., Inc., Kenilworth, N.J., U.S.A.との協業により、その成果はより大きなものとなりました」と述べています。
本承認は、FDAのリアルタイムオンコロジーレビュー(Real-Time Oncology Review:RTOR)パイロットプログラムの下で審査されました。RTORは、有効な治療法をできる限り早く患者さんにお届けできるように、より効率的な承認審査を追求したプログラムです。
Robert Motzer 博士は、Merck & Co, Inc., Kenilworth, N.J., U.S.A.およびエーザイに対して
コンサルテーションとアドバイザリーサービスを提供しています。
本承認の基となった試験結果について
本承認は、進行性腎細胞がんの一次治療を評価する、1,069人の患者さんが参加された多施設共同非盲検無作為化の臨床第Ⅲ相CLEAR試験(307)/KEYNOTE-581試験(ClinicalTrials.gov, NCT02811861)の結果に基づいています。患者さんはPD-L1の発現状態に関わらず、登録されました。活動性の自己免疫疾患、または免疫抑制が必要な健康状態の患者さんは、本試験の登録に不適格と判断されました。無作為化の層別因子は、地域 (北米および西欧、またはその他の地域)とMemorial Sloan Kettering Cancer Center (MSKCC)予後予測分類(低リスク、中リスク、または高リスク)でした。
患者さんは以下のいずれかの投与群に1:1:1で割り付けられました。
- LENVIMA®(20 mg、1日1回経口投与)とKEYTRUDA®(200 mg、3 週ごと静脈内投与を1サイクルとし最大で24 カ月まで投与)の併用
- LENVIMA®(18 mg、1日1回経口投与)とエベロリムス(5 mg、1日1回経口投与)の併用
- 対照薬であるスニチニブ単剤(50 mg、1日1回経口投与、4週間投与後、2週間休薬)
治験薬の投与は、許容できない毒性が出現するまで、または増悪とされるまで継続されました。KEYTRUDA®とLENVIMA®の併用療法は、患者さんが臨床的に病勢安定と診断され、治験医師によって臨床的有用性が認められる場合、RECIST(固形がんに対する腫瘍径の変化を効果判定に用いる評価基準)で定義された増悪後も投与継続が認められました。KEYTRUDA®の投与は最大で24 カ月まで継続されました。LENVIMA®は24 カ月を超えて投与継続が認められました。腫瘍評価はベースラインおよび8 週毎に行われました。
試験の登録患者集団の特徴は、年齢の中央値62 歳(範囲: 29-88 歳)、65歳以上42%、男性75%、人種: 白人74%、アジア人21%、黒人1%、他の人種2%、Karnofsky Performance Status(KPS、全身状態のスコアで、スコアが高いほど状態がよい)70-80と90-100がそれぞれ18%、82%でした。MSKCC予後予測分類では、低リスク27%、中リスク64%、高リスク9%でした。頻度の高い転移部位は肺(68%)、リンパ節(45%)、骨(25%)でした。
本試験の主要有効性アウトカムの指標は、RECIST v1.1に基づく独立画像判定によるPFSおよびOSでした。付加的な有効性アウトカムの指標には、独立画像判定によるORRが含まれました。本試験では、KEYTRUDA®とLENVIMA®の併用療法は、スニチニブと比較して、PFS、OS、およびORRを統計的有意に改善しました。有効性は以下のとおりでした。
KEYTRUDA®とLENVIMA®の併用療法の投与期間の中央値は17カ月(範囲:0.1-39カ月)でした。
致死的な有害事象(fatal adverse reactions)はKEYTRUDA®とLENVIMA®の併用療法による治療中の患者さんのうち4.3%に発現し、心肺停止(0.9%)、敗血症(0.9%)、不整脈(以下の項目はすべて1 例ずつで0.3%) 、自己免疫性肝炎、呼吸困難、高血圧クリーゼ、血中クレアチニン増加、多臓器機能不全症候群、筋無力症候群、心筋炎、腎炎、肺臓炎、動脈瘤破裂、およびくも膜下出血が含まれました。
KEYTRUDA®とLENVIMA®の併用療法による治療中の患者さんのうち、51%に重篤な有害事象(serious adverse reactions)が発現しました。発現した重篤な有害事象(発現率2%以上)は、出血性イベント(5%)、下痢(4%)、高血圧(3%)、心筋梗塞(3%)、肺臓炎(3%)、嘔吐(3%)、急性腎障害(2%)、副腎機能不全(2%)、呼吸困難 (2%)、および肺炎(2%)でした。
KEYTRUDA®とLENVIMA®の併用療法による治療中の患者さんのうち、KEYTRUDA®、LENVIMA®、または両薬剤の恒久的な投与中止に至った有害事象(adverse reaction)は、37%の患者さんに出現し、KEYTRUDA®のみは29%、LENVIMA®のみは26%、両薬剤は13%でした。KEYTRUDA®、LENVIMA®または両薬剤の恒久的な投与中止に至った頻度の高い有害事象(発現率2%以上)は、肺臓炎(3%)、心筋梗塞(3%)、肝毒性(3%)、急性腎障害(3%)、発疹(3%)、および下痢(2%)でした。
KEYTRUDA®とLENVIMA®の併用療法による治療中の患者さんのうち、78%にKEYTRUDA®、LENVIMA®または 両薬剤の休薬に至った有害事象が発現し、KEYTRUDA®55%、LENVIMA®73%、両薬剤39%でした。KEYTRUDA®の休薬に至った頻度の高い有害事象(発現率3%以上)は、下痢(10%)、肝毒性(8%)、疲労(7%)、リパーゼ増加(5%)、 アミラーゼ増加(4%)、筋骨格痛(3%)、高血圧(3%)、発疹(3%)、急性腎障害(3%)、および食欲減退(3%)でした。患者さんの 69%は、LENVIMA®を減量されました。LENVIMA®の減量または休薬に至った頻度の高い有害事象(発現率5%以上)は、下痢(26%)、疲労(18%)、高血圧(17%)、蛋白尿(13%)、食欲減退(12%)、手掌・足底発赤知覚不全症候群(11%)、悪心(9%)、口内炎(9%)、筋骨格痛(8%)、発疹(8%)、リパーゼ増加(7%)、腹痛(6%)、嘔吐(6%)、アラニンアミノトランスフェラーゼ(ALT)増加(5%)、アミラーゼ増加(5%)でした。KEYTRUDA®とLENVIMA®の併用療法による治療中の患者さんのうち、15%に免疫介在性有害事象に対して、経口プレドニゾン40mg 相当量(一日あたり)以上が投与されました。グレード3およびグレード4のALT増加、またはアスパラギン酸アミノトランスフェラーゼ(AST)増加は9%の患者様に発現しました。グレード2以上のALT増加、またはAST増加は、64人(18%)の患者様において報告され、そのうち20人(31%)は、経口プレドニゾン 40mg 相当量(一日あたり)以上を投与されました。グレード2 以上のALT増加、またはAST 増加の再発は、LENVIMA®を再投与された患者さん3人および、本併用療法を再投与された患者さん10人に発現しました。
KEYTRUDA®とLENVIMA®の併用療法によって発現した頻度の高い有害事象(全グレード、発現率20%以上) は、疲労(63%)、下痢(62%)、筋骨格系障害(58%)、甲状腺機能低下症(57%)、高血圧(56%)、口内炎 (43%)、食欲減退(41%)、発疹(37%)、悪心(36%)、体重減少(30%)、発声障害(30%)、蛋白尿(30%)、手掌・足底発赤知覚不全症候群(29%)、出血性イベント(27%)、腹痛(27%)、嘔吐(26%)、便秘(25%)、肝毒性 (25%)、頭痛(23%)、および急性腎障害(21%)でした。KEYTRUDA®とLENVIMA®の併用療法によって発現した頻度の高い有害事象(グレード3-4)は、高血圧(29%)、下痢(10%)、疲労(9%)、肝毒性(9%)、体重減少 (8%)、蛋白尿(8%)、急性腎障害(5%)、出血性イベント(5%)、発疹(5%)、筋骨格系障害(4%)、食欲減退 (4%)、手掌・足底発赤知覚不全症候群(4%)、悪心(3%)、嘔吐(3%)、口内炎(2%)、腹痛(2%)、便秘(1%)、甲状腺機能低下症(1%)、および頭痛(1%)でした。
KEYTRUDA®とLENVIMA®の併用療法による治療中の患者さんに発現した臨床的に意義のある有害事象 (Clinically relevant adverse reaction、発現率20%未満)は、心筋梗塞(3%)および狭心症(1%)でした。
腎細胞がんについて
腎がんの罹患者数は2020年において、世界で43万1千人以上と推定され、17万9千人以上が亡くなったと推定されています。米国では2021年において、約7万6千人が新たに診断され、約1万4千人が亡くなられると推定されています。腎細胞がんは、腎臓における最も発生頻度の高いがんで、腎がんの約9割を占めるとされています。男性は女性の約2倍の頻度で発症するとされています。腎細胞がんは、多くの場合、他の腹部疾患の画像診断時に発見されます。腎細胞がん患者さんの約30%は、診断時に転移が確認されます。生存率は診断時のステージによって大きく変わりますが、転移性腎細胞がんの5年生存率は13%と推計されています。
KEYTRUDA®について
KEYTRUDA®は、自己の免疫力を高め、がん細胞を見つけて攻撃するのを助ける抗PD-1抗体です。KEYTRUDA®はPD-1とそのリガンドであるPD-L1およびPD-L2との相互作用を阻害して、がん細胞を攻撃する Tリンパ球を活性化するヒト化モノクローナル抗体です。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.は業界最大のがん免疫療法臨床研究プログラムを行っており、現在1,500を超えるKEYTRUDA®の臨床試験を実施し、幅広い種類のがんや治療セッティングを検討しています。KEYTRUDA®の臨床プログラムでは、さまざまながんにおけるKEYTRUDA®の役割や、KEYTRUDA®による治療効果が得られる可能性を予測する因子について模索しており、さまざまなバイオマーカーの模索も行っています。
KEYTRUDA®用法・用量・安全性情報について
用法・用量・安全性情報など一部情報は米国のもので、日本の情報ではありません。詳しくは当社英文リリースをご参照ください。
LENVIMA®(レンバチニブ)カプセルついて
LENVIMA®は、血管内皮増殖因子受容体(VEGFR)であるVEGFR1、VEGFR2、VEGFR3や線維芽細胞増殖因子受容体(FGFR) のFGFR1、FGFR2、FGFR3、FGFR4に加え、血小板由来増殖因子受容体(PDGFR)のPDGFRα、KIT、RETなどの腫瘍血管新生あるいは腫瘍悪性化に関与する受容体型チロシンキナーゼに対する選択的阻害活性を有する、経口投与可能なエーザイ創製のマルチキナーゼ阻害剤です。LENVIMA®とエベロリムスの併用は、in vitro モデルにおける血管内皮細胞増殖、管腔形成およびVEGFシグナル伝達の抑制ならびにマウスの腫瘍モデルにおけるヒト腎細胞がんの容積減少で示されているように、それぞれの単剤療法を上回る血管新生阻害活性および抗腫瘍活性を示しました。マウスの腫瘍モデルにおいて、抗PD-1モノクローナル抗体併用により、LENVIMA®は、腫瘍関連マクロファージの割合を減少させ、活性化細胞傷害性T細胞を増加させることで、それぞれの単剤療法を上回る抗腫瘍活性を示しました。
LENVIMA®用法・用量・安全性情報について
米国におけるLENVIMA®の用法・用量・安全性情報については、LENVIMA®製品ウェブサイト( http://www.lenvima.com )をご覧ください。
エーザイとMerck & Co., Inc., Kenilworth, N.J., U.S.A.による戦略的提携について
2018年3月に、エーザイとMerck & Co., Inc., Kenilworth, N.J., U.S.A. (米国とカナダ以外ではMSD)は、LENVIMA®のグローバルな共同開発および共同販促を行う戦略的提携に合意しました。本合意に基づき、両社は、LENVIMA®について、単剤療法およびMerck & Co., Inc., Kenilworth, N.J., U.S.A.の抗PD-1抗体KEYTRUDA®の併用療法における共同開発、共同製造、共同販促を行います。
既に実施しているKEYTRUDA®とLENVIMA®の併用試験に加え、両社は新たにLEAP(LEnvatinib And Pembrolizumab)臨床プログラムを開始しました。これにより、KEYTRUDA®とLENVIMA®の併用療法は13種類のがんにおける20以上の臨床試験が進行中です。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.のがん領域における取り組み
Merck & Co., Inc., Kenilworth, N.J., U.S.A.では、画期的な科学を革新的ながん治療薬に変換して世界中のがん患者さんを助けることに取り組んでいます。当社のオンコロジー事業にとって、がんと闘う人々を助けることは私たちの情熱であり、がん治療薬へアクセスしやすくすることは私たちの責任です。また、がん領域における取り組みの一環として、医薬品業界で一二を争う急成長を遂げている開発プログラムにより、30種類以上のがんに対するがん免疫療法の可能性を模索しています。また、引き続き戦略的買収を通じてポートフォリオを強化し、進行がんの治療を改善する可能性をもつ有望ながん治療薬候補の開発を最優先に進めています。当社のオンコロジー臨床試験について詳しくは、当社ウェブサイトをご覧ください。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.について
Merck & Co., Inc., Kenilworth, N.J., U.S.A.(米国とカナダ以外ではMSD)は130年にわたり、人々の生命を救い、人生を健やかにするというミッションのもと、世界で最も治療が困難な病気のために、革新的な医薬品やワクチンの発見、開発、提供に挑みつづけてきました。また、多岐にわたる政策やプログラム、パートナーシップを通じて、患者さんの医療へのアクセスを推進する活動に積極的に取り組んでいます。私たちは、今日、がん、HIVやエボラといった感染症、そして新たな動物の疾病など、人類や動物を脅かしている病気の予防や治療のために、研究開発の最前線に立ち続け、世界最高の研究開発型バイオ医薬品企業を目指しています。詳細については、当社ウェブサイトや Twitter 、 Facebook 、 Instagram 、 YouTube、Linkedlnをご参照ください。
エーザイのがん領域の取り組みについて
エーザイは、がん領域において、真の患者様ニーズが満たされておらず、かつ当社がフロントランナーとなり得る機会(立地)として、既存の創製薬による経験知を活かした「がん微小環境」とRNAスプライシングプラットフォーム等を用いた「ドライバー遺伝子変異とスプライシング異常」を標的とした抗がん剤の開発にフォーカスしています。これらの立地から新たな標的や作用機序を有する革新的新薬を創出し、がんの治癒の実現に向けて貢献することをめざしています。
エーザイについて
エーザイは、患者様とそのご家族の喜怒哀楽を第一義に考え、そのベネフィット向上に貢献する「ヒューマン・ヘルスケア(hhc)」を企業理念としています。当社はグローバルな研究開発・生産・販売拠点ネットワークを持ち、hhcの実現に向けて戦略的重要領域と位置づける「神経領域」「がん」を中心とするアンメット・メディカル・ニーズの高い疾患領域において、世界中の約1万人の社員が革新的な新薬の創出と提供に取り組んでいます。当社はhhcの理念のもと、サイエンス、臨床科学、患者様の視点から、顧みられない熱帯病、持続可能な開発目標(SDGs)を含む世界のアンメット・メディカル・ニーズに対して、革新的なソリューションの提供をめざします。
エーザイ株式会社の詳細情報は、www.eisai.com (グローバル), us.eisai.com (米国) またはhttp://www.eisai.eu (欧州、中東、アフリカ)をご覧ください。 Twitter (米国、グローバル) および LinkedIn (米国)でも情報公開しています。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.の将来に関する記述
このニュースリリースには、米国の1995年私的証券訴訟改革法(the Private Securities Litigation Reform Act of 1995)の免責条項で定義された「将来に関する記述」が含まれています。これらの記述は、Merck & Co., Inc., Kenilworth, N.J., U.S.A.の経営陣の現時点での信条と期待に基づくもので、相当のリスクと不確実性が含まれています。新薬パイプラインに対する承認取得またはその製品化による収益を保証するものではありません。予測が正確性に欠けていた場合またはリスクもしくは不確実性が現実化した場合、実際の成果が、将来に関する記述で述べたものと異なる場合も生じます。
リスクと不確実性には、業界の一般的な状況および競争環境、金利および為替レートの変動などの一般的な経済要因、昨今の新型コロナウイルス感染症(COVID-19)の世界的大流行の影響、医薬品業界の規制やヘルスケア関連の米国法および国際法が及ぼす影響、ヘルスケア費用抑制の世界的な傾向、競合他社による技術的進歩や新製品開発および特許取得、承認申請などの新薬開発特有の問題、Merck & Co., Inc., Kenilworth, N.J., U.S.A.による将来の市況予測の正確性、製造上の問題または遅延、国際経済および政府の信用リスクなどの金融不安、画期的製品に対するMerck & Co., Inc., Kenilworth, N.J., U.S.A.の特許権やその他の保護の有効性への依存、特許訴訟や規制措置の対象となる可能性等がありますが、これらに限定されるものではありません。
Merck & Co., Inc., Kenilworth, N.J., U.S.A.は、新たな情報、新たな出来事、その他いかなる状況が加わった場合でも、将来に関する記述の更新を行う義務は負いません。将来に関する記述の記載と大きく異なる成果を招くおそれがあるこの他の要因については、Merck & Co., Inc., Kenilworth, N.J., U.S.A.に関するForm 10-Kの2019年度年次報告書および米国証券取引委員会(SEC)のインターネットサイト
(www.sec.gov)で入手できるSECに対するその他の書類で確認できます。
# # #
MSDについて
MSD(Merck & Co., Inc., Kenilworth, N.J., U.S.A.が米国とカナダ以外の国と地域で事業を行う際に使用している名称)は、130年にわたり、人々の生命を救い、人生を健やかにするというミッションのもと、世界で最も治療が困難な病気のために、革新的な医薬品やワクチンの発見、開発、提供に挑みつづけてきました。MSDはまた、多岐にわたる政策やプログラム、パートナーシップを通じて、患者さんの医療へのアクセスを推進する活動に積極的に取り組んでいます。私たちは、今日、がん、HIVやエボラといった感染症、そして新たな動物の疾病など、人類や動物を脅かしている病気の予防や治療のために、研究開発の最前線に立ち続けています。MSDは世界最高の研究開発型バイオ医薬品企業を目指しています。MSDの詳細については、弊社ウェブサイト(www.msd.co.jp)やFacebook、Twitter、YouTubeをご参照ください。